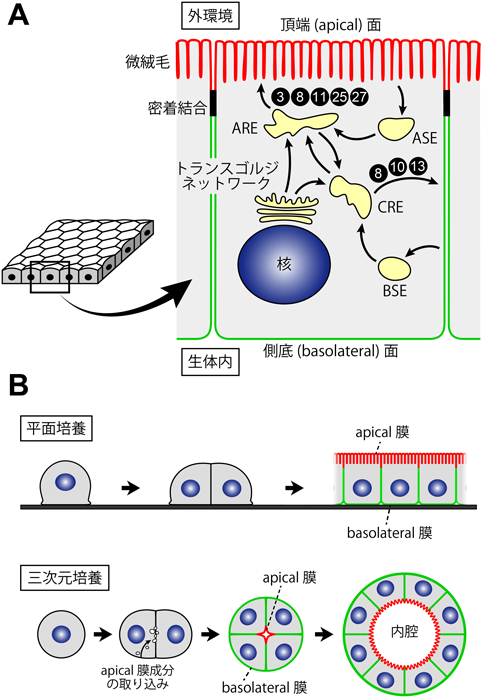
上皮細胞は,生体の体表や内腔面の最外側を覆う細胞であり,外環境と生体内を隔てる物理的なバリアとなるだけでなく,分泌や吸収など,外環境との方向性を持った物質のやりとりを行う.このため上皮細胞は,頂端(apical)面(外環境側)および側底(basolateral)面(生体内側)と呼ばれる二つの異なる膜領域を有しており,それぞれの膜に特異的な受容体やトランスポーター,脂質などが局在する(図1A).二つの領域は密着結合(タイトジャンクション)により仕切られて側方拡散が制限されているため,この膜極性を形成・維持するためには,特異的な小胞輸送経路(メンブレントラフィック)によってそれぞれの膜成分を正しく選別して運ぶことが必要である(極性輸送)1).apical膜タンパク質とbasolateral膜タンパク質はそれぞれ,apical recycling endosome(ARE)およびcommon recycling endosome(CRE)と呼ばれる別々のリサイクリングエンドソームを経由して細胞膜へ運ばれる.両者を別の輸送小胞に組み込むための積み荷分子の選別は,主にトランスゴルジネットワークとリサイクリングエンドソームで行われると考えられている.apical膜に輸送される積み荷分子として,インフルエンザウイルスHAタンパク質,GPIアンカータンパク質,ジペプチジルペプチダーゼIV, p75ニューロトロフィン受容体などが知られており,脂質ラフトとの相互作用や糖鎖修飾が選別シグナルとして働く.一方,basolateral膜へ輸送される積み荷分子として,低密度リポタンパク質(LDL)受容体,トランスフェリン受容体,水疱性口内炎ウイルス糖タンパク質(VSVG)などが知られており,AP-1B複合体がこれらのタンパク質の細胞質側のモチーフ(選別シグナル)と結合し,クラスリン小胞に取り込むことで積み荷分子の選別を行っている.
イヌ腎臓尿細管由来の細胞株であるMDCK(Madin–Darby canine kidney)細胞は,コンフルエントになると細胞どうしが密に接着して一層の上皮様シートを形成するため,apical面・basolateral面へ向けた上皮極性輸送研究のモデル細胞として頻用されてきた(図1B,上段).また近年では,平面基質上での単層上皮構造(平面培養)だけでなく,より生体内での条件に近いと考えられるコラーゲンゲルやマトリゲルなどの細胞外基質中で培養を行い(三次元培養),シスト(管腔)構造を形成させるモデルもよく用いられる.このシスト形成の過程においても,メンブレントラフィックを介したapical膜の取り込みと再配置が細胞極性の確立に重要な役割を果たす(図1B,下段).
2. 上皮極性輸送に関与する低分子量Gタンパク質Rab
Rabは,他の低分子量Gタンパク質であるRasやRhoなどと同じく,GTPと結合した活性型とGDPと結合した不活性型をサイクルする分子スイッチとして働く2).哺乳類では約60種の遺伝子からなるファミリーを構成している.Rabは,活性型において特定の小胞やオルガネラに局在し,特異的なエフェクタータンパク質をリクルートすることで,膜の出芽・輸送・融合などのメンブレントラフィックの各ステップを制御する.以下に,これまでに上皮細胞における極性輸送への関与が報告されているRabの機能を解説する.
1)Rab3, Rab27
Rab3(A/B/C/D)とRab27(A/B)は近縁の分子であり,どちらも神経細胞や内分泌細胞において分泌顆粒に局在するRabとしてよく知られている.エフェクターとしてRim, Rabphilin, Slpファミリー分子などをリクルートして小胞の繋留と融合を促進することで,調節性分泌を制御する.上皮細胞においては,Rab3, Rab27, Slp2-a, Slp4-aはいずれもapical膜成分を含む小胞に局在し,この小胞がapical面(内腔面)へエキソサイトーシスするのに必要である3, 4).これらの分子をノックダウンしたMDCK細胞は,内腔を形成できなかったり,異所的に複数の内腔を形成してしまったりする.
2)Rab8, Rab10
Rab8(A/B),Rab10はどちらも酵母において極性分泌を制御するSec4pの哺乳類ホモログに相当する.哺乳類上皮細胞においては,Rab8やRab10の恒常活性化型の発現がVSVGやLDL受容体の輸送に影響を与えることから,basolateral面へ向けた輸送への関与が示唆されている5, 6).しかし一方で,Rab8のノックアウトマウスではbasolateral面へのタンパク質輸送には影響がみられず,apical膜成分を含む小胞の蓄積がみられる(微絨毛封入体病の表現型に似る)ことから,むしろRab8はapical面への輸送を制御していると考えられる7).またRab8は,シスト形成においても,Rab3やRab27と同様にapical膜成分を含む小胞を輸送するのに必要であることが示されている8).この際のRab8のエフェクターとして,ミオシンVb9)や小胞繋留因子であるExocyst複合体8)が重要である.Rab10のシスト形成への関与も示唆されているが,解析は十分に進んでいない6).
3)Rab11, Rab25
Rab11(A/B)はリサイクリングエンドソームを介した輸送の制御因子としてよく知られているが,上皮細胞においては特にAREに局在し,AREからapical膜へ向けた小胞輸送に関与する10).Rab118, 11)およびそのエフェクターであるミオシンVb9),FIP5(Rip11)12)のいずれも,シスト形成や個体レベルでの上皮極性形成における重要性が示されている.また,Rab11と相同性の高いRab25(Rab11Cとも呼ばれる)も,apical膜への輸送やシスト形成への関与が報告されている8, 10).
4)その他のRab
乳腺上皮細胞において,Rab5Aの恒常不活性型を発現させるとシスト構造の形成が阻害されることから,マトリゲルに応答したapical膜のトランスサイトーシスにRab5が関与していると考えられる13).またRab13とそのエフェクターのMICAL-L2が,claudin-1やoccludinなどを細胞間接着部位へ輸送するのに重要であることが示されている14).
3. podocalyxinの輸送を制御するRabの網羅的解析
最後に,最近当研究室で行われた,podocalyxin(gp135)の輸送を制御するRabファミリー分子の網羅的な解析について紹介する15).podocalyxinは,上皮細胞のapical膜に局在する1回膜貫通型タンパク質であり,細胞外ドメインの多数のシアル化修飾による負電荷の反発によって,内腔面の拡張を助けると考えられている.三次元培養において,podocalyxinを含むapical膜成分はエンドサイトーシスによって細胞内に取り込まれた後,初期エンドソーム,リサイクリングエンドソームを経由して,分裂した細胞どうしの接着面へ運ばれる.やがて細胞外基質と接していないこの部位に新たなapical面が形成され,内腔が拡張していき,シスト構造が形成される.
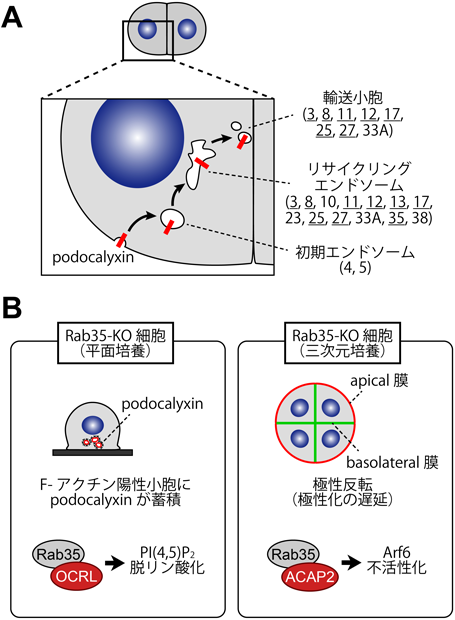
podocalyxinの輸送に関与するRabの全容を明らかにするため,まず平面培養のMDCK細胞に,哺乳類に存在する60種のRab分子を発現させ,これらとpodocalyxinとの共局在を極性化の時間経過を追って観察した.するとpodocalyxinは,自身のトランスサイトーシス経路に沿って,初期エンドソームにおいてRab4, Rab5と,リサイクリングエンドソームにおいてRab3, Rab8, Rab10, Rab11, Rab12, Rab13, Rab17, Rab23, Rab25, Rab27, Rab33A, Rab35, Rab38と,輸送小胞においてRab3, Rab8, Rab11, Rab12, Rab17, Rab25, Rab27, Rab33Aとよく共局在するのが観察された(図2A).
次に,これらの共局在するRabをノックダウンした際に,podocalyxinの局在に影響がみられるかを検証した.すると,これまで報告されていたRab3, Rab8, Rab11, Rab27に加え,新たにRab13, Rab17のノックダウンでも,細胞膜付近でのpodocalyxinの蓄積が観察された.また,より早い段階での異常として,Rab12, Rab35のノックダウンによるpodocalyxinの細胞質内での小胞状の蓄積が観察された.このときの小胞状蓄積は,Rab12ノックダウンの場合はF-アクチン染色陰性であるのに対し,Rab35ノックダウンの場合はF-アクチン染色陽性であったため,両者の表現型は異なると考えられた.また,Rab14のノックダウンでは底面からのpodocalyxinの取り込みの遅延が観察された.
続いて,三次元培養においても同様のノックダウン実験を行ったところ,興味深いことに平面培養とは異なる表現型を示すものが見つかった.たとえば,Rab13やRab14のノックダウンは三次元培養でのpodocalyxin輸送やシスト形成に影響を与えなかった.逆に,Rab25のノックダウンは平面培養では影響がなかったが,三次元培養では管腔の形成が阻害された.また,Rab35のノックダウンでは平面培養と異なり,podocalyxinを含む小胞がapical面直下で蓄積するのが観察された.また,シストの極性化自体が遅くなっており,播種から24時間後においてもapical膜が細胞集団の外側に残っている状態(極性反転:inverted polarity)が多く観察された(図2B).
この点をさらに詳しく解析するため,Cas9を用いてRab35をノックアウトしたMDCK細胞株を樹立した(Rab35-KO細胞).この細胞におけるpodocalyxinの局在を観察したところ,ノックダウン実験と同じく,平面培養においてはF-アクチン陽性のドットへの蓄積が,また三次元培養においてはシストの極性反転が観察された.Rab35の機能不全による影響が異なるのは,二つの培養条件でRab35が関与する輸送ステップが異なるからであると考え,それぞれに必要なエフェクターの違いに注目した.これまでに知られているRab35のエフェクターをノックダウンしたところ,平面培養においては,OCRL(inositol polyphosphate-5-phosphatase)のノックダウンによってRab35-KO細胞と同じ表現型(podocalyxinのアクチン陽性ドットへの蓄積)が誘導された.一方,三次元培養における表現型(極性反転)は,ACAP2(centaurin β2)のノックダウンによって誘導された(図2B).
OCRLは,ホスファチジルイノシトール類の5位の脱リン酸化酵素(脂質ホスタファーゼ)であり,初期エンドソームを介した輸送を制御する.OCRLのノックダウンによって,OCRLの基質であるホスファチジルイノシトール4,5-ビスリン酸(PI(4,5)P2)が初期エンドソームに過剰に蓄積し,N-WASPを介したF-アクチンの重合を促進することが報告されている.Rab35およびOCRLの機能を欠損したMDCK細胞におけるpodocalyxinの輸送も初期エンドソームの段階で阻害されたために,podocalyxinがF-アクチン陽性の小胞に蓄積したと考えられる.またACAP2は,低分子量Gタンパク質Arf6(Rabとは異なるタイプの輸送制御因子)の不活性化因子であり,Arf6のノックダウンもシストの極性反転を引き起こすことから,細胞外基質に応答したシストの極性形成には,Rab35, ACAP2, Arf6の協調的な働きが必要であることが示唆された.このように平面培養と三次元培養では,(おそらく極性化を引き起こす引き金の違いにより)podocalyxin輸送のメカニズムに異なる部分があり,その両方に異なるエフェクターを介してRab35が関与することが示された.