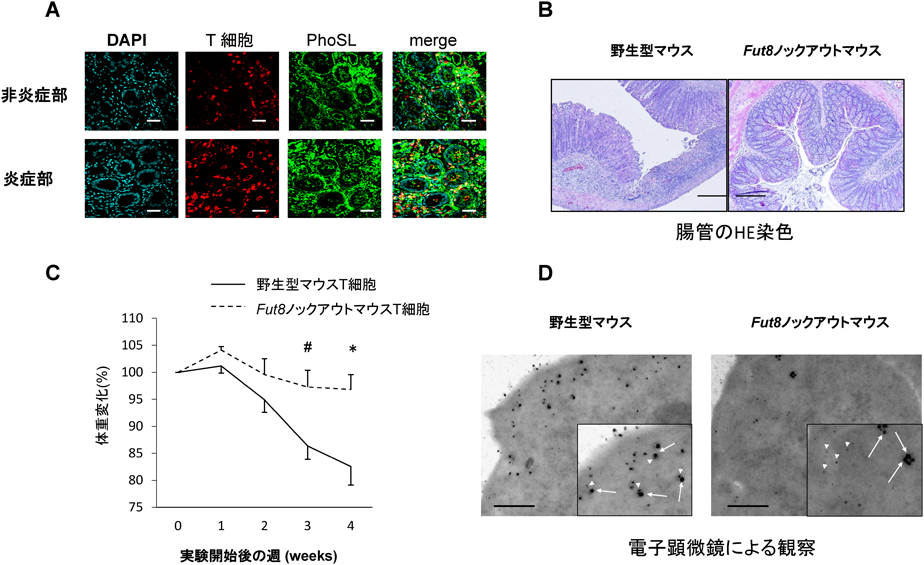
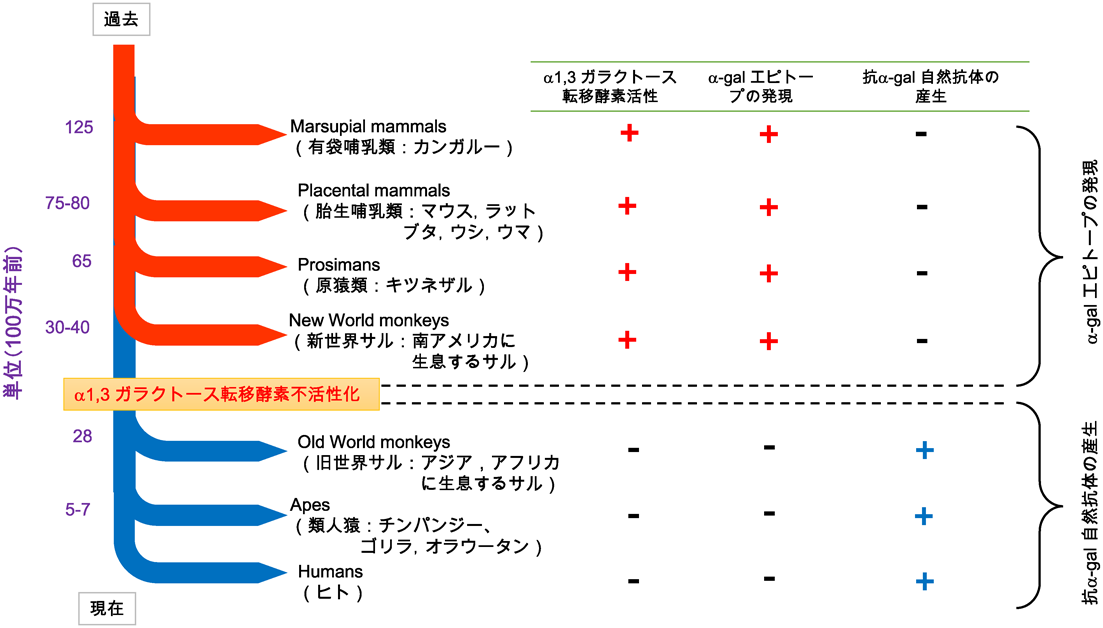
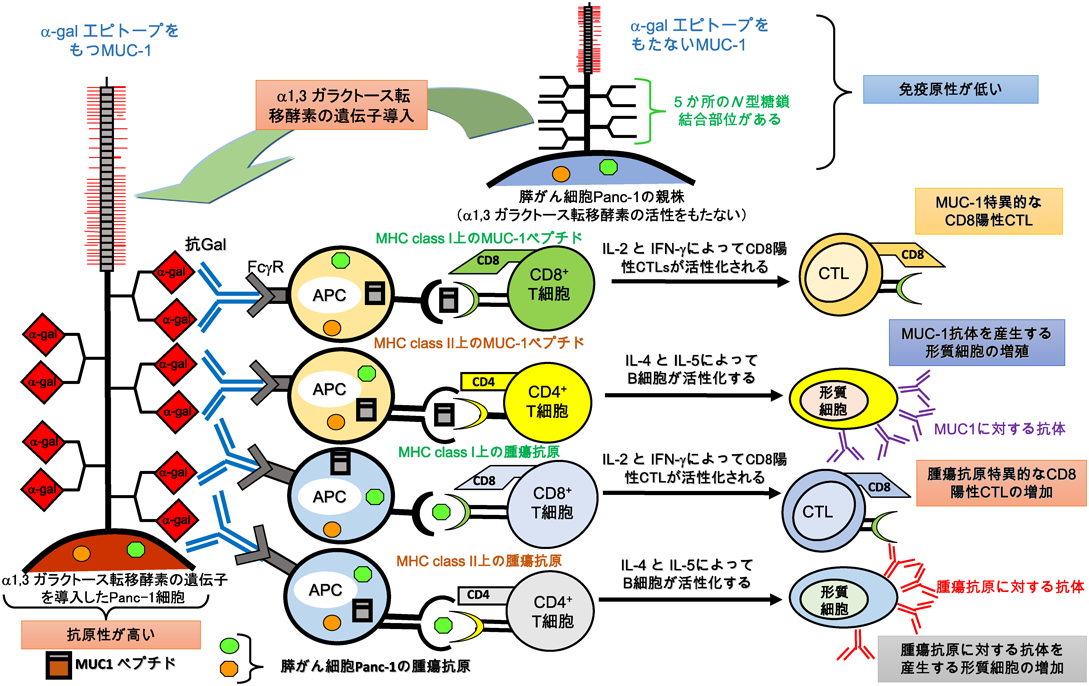
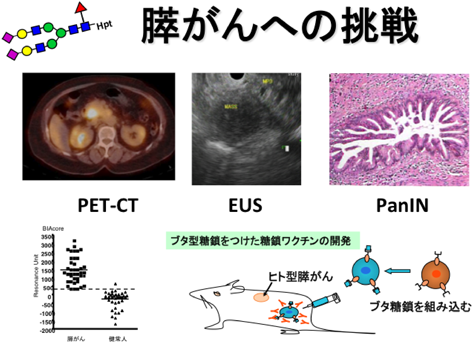
疾患糖鎖の解析から糖鎖治療へComprehensive analysis of disease-related glycosylation, leading to glyco-therapy
1 大阪大学大学院医学系研究科機能診断科学Osaka University Graduate School of Medicine, Department of Molecular Biochemistry & Clinical Investigation ◇ 〒565–0871 吹田市山田丘1–7 ◇ 1–7 Yamada-oka, Suita 565–0871, Japan
2 同消化器内科学Osaka University Graduate School of Medicine, Department of Gastroenterology & Hepatology ◇ 〒565–0871 吹田市山田丘2–2 ◇ 2–2 Yamada-oka, Suita 565–0871, Japan
3 大阪警察病院外科Osaka Police Hospital, Department of Surgery ◇ 〒543–0035 大阪府天王寺区北山町10–30 ◇ 10–31 Kitayama-cho, Tennouji, Osaka 543–0035, Japan