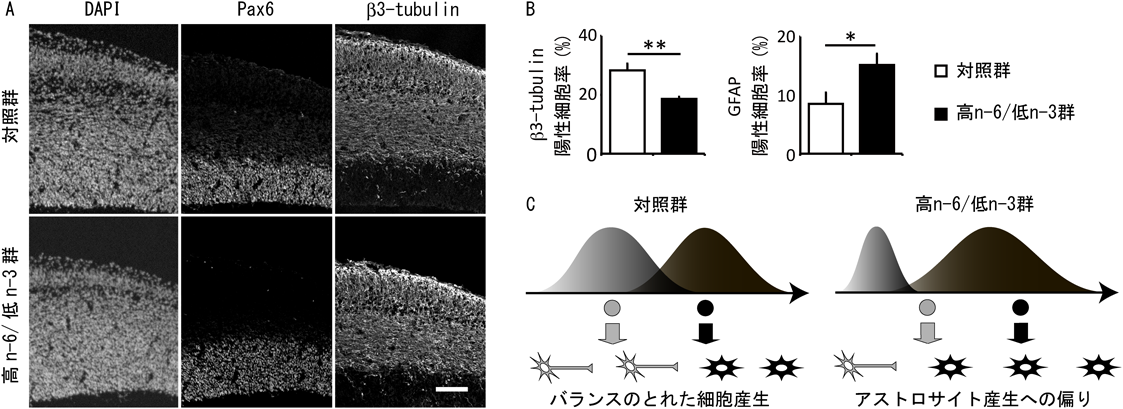
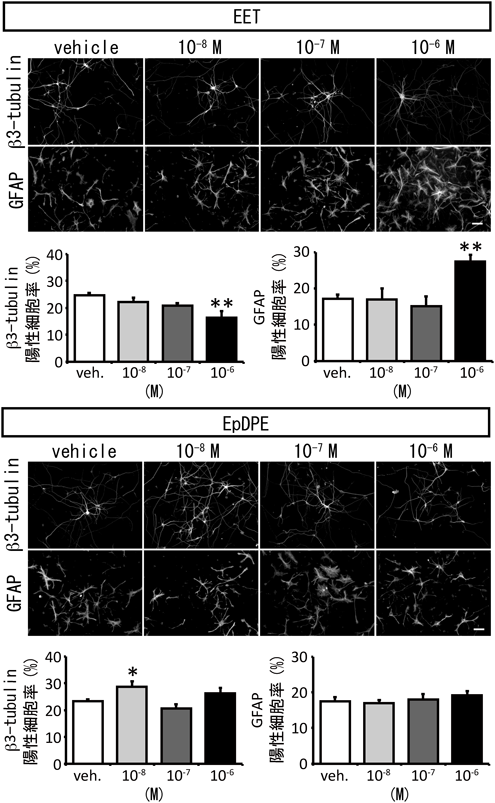
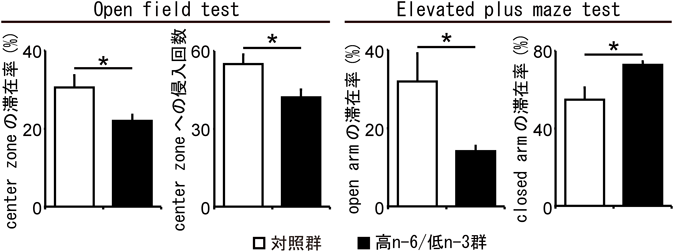
多価不飽和脂肪酸の大脳新皮質形成における役割The effect of polyunsaturated fatty acids on neocortical development
東北大学大学院医学系研究科発生発達神経科学分野Department of Developmental Neuroscience, Center for Neuroscience, United Centers for Advanced Research and Translational Medicine, Tohoku University School of Medicine ◇ 〒980–8575 宮城県仙台市青葉区星陵町2–1 ◇ 2–1 Seiryo-machi, Aoba-ku, Sendai, Miyagi 980–8575