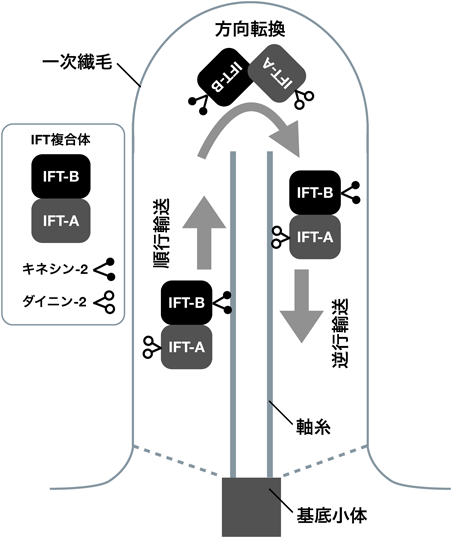
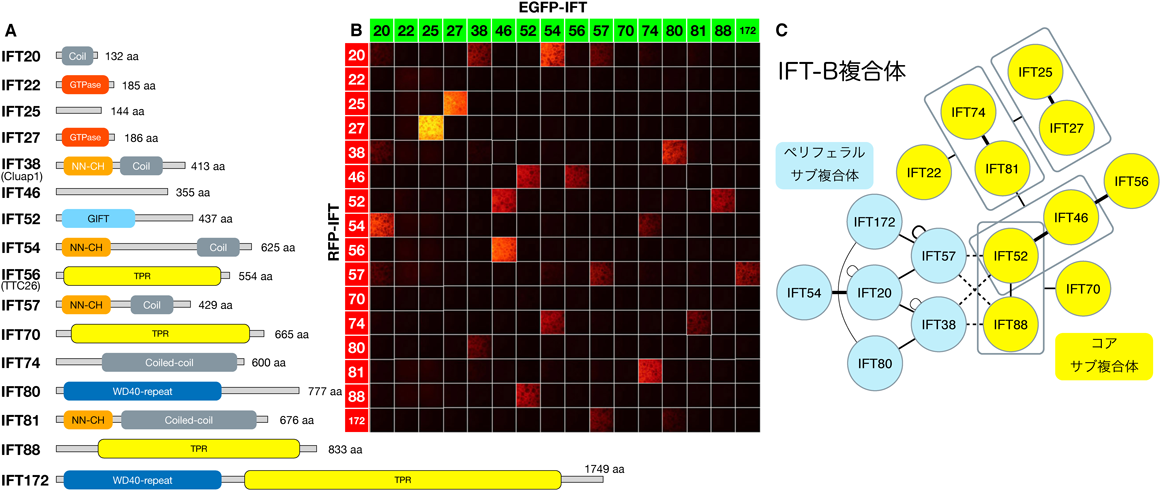
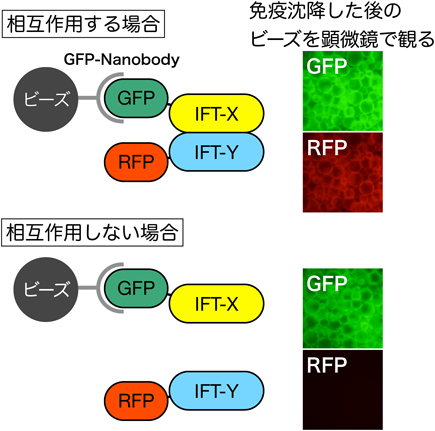
14) Katoh, Y., Michisaka, S., Nozaki, S., Funabashi, T., Hirano, T., Takei, R., & Nakayama, K. (2017) Mol. Biol. Cell, 28, in press.
17) Boldt, K., van Reeuwijk, J., Lu, Q., Koutroumpas, K., Nguyen, T.-M.T., Texier, Y., van Beersum, S.E.C., Horn, N., Willer, J.R., Mans, D.A., Dougherty, G., Lamers, I.J.C., Coene, K.L.M., Arts, H.H., Betts, M.J., Beyer, T., Bolat, E., Gloeckner, C.J., Haidari, K., Hetterschijt, L., Iaconis, D., Jenkins, D., Klose, F., Knapp, B., Latour, B., Letteboer, S.J.F., Marcelis, C.L., Mitic, D., Morleo, M., Oud, M.M., Riemersma, M., Rix, S., Terhal, P.A., Toedt, G., van Dam, T.J.P., de Vrieze, E., Wissinger, Y., Wu, K.M., Apic, G., Beales, P.L., Blacque, O.E., Gibson, T.J., Huynen, M.A., Katsanis, N., Kremer, H., Omran, H., Van Wijk, E., Wolfrum, U., Kepes, F., Davis, E.E., Franco, B., Giles, R.H., Ueffing, M., Russell, R.B., Roepman, R., Al-Turki, S., Anderson, C., Antony, D., Barroso, I., Bentham, J., Bhattacharya, S., Carss, K., Chatterjee, K., Cirak, S., Cosgrove, C., Danecek, P., Durbin, R., Fitzpatrick, D., Floyd, J., Reghan Foley, A., Franklin, C., Futema, M., Humphries, S.E., Hurles, M., Joyce, C., McCarthy, S., Mitchison, H.M., Muddyman, D., Muntoni, F., O’Rahilly, S., Onoufriadis, A., Payne, F., Plagnol, V., Raymond, L., Savage, D.B., Scambler, P., Schmidts, M., Schoenmakers, N., Semple, R., Serra, E., Stalker, J., van Kogelenberg, M., Vijayarangakannan, P., Walter, K., Whittall, R., & Williamson, K.; UK10K Rare Diseases Group. (2016) Nat. Commun., 7, 11491.