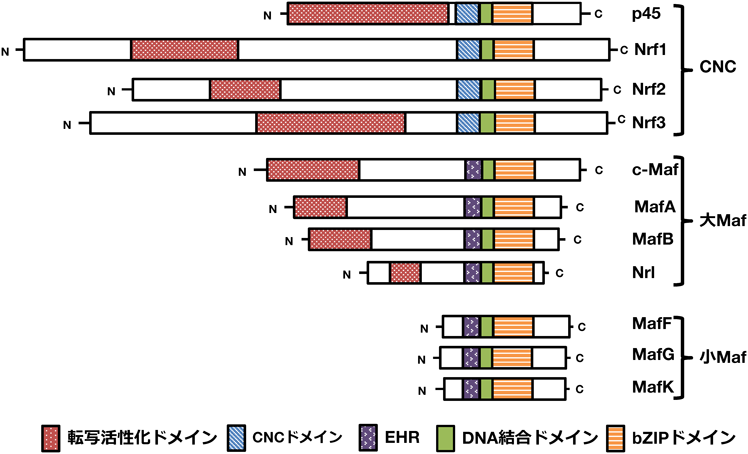
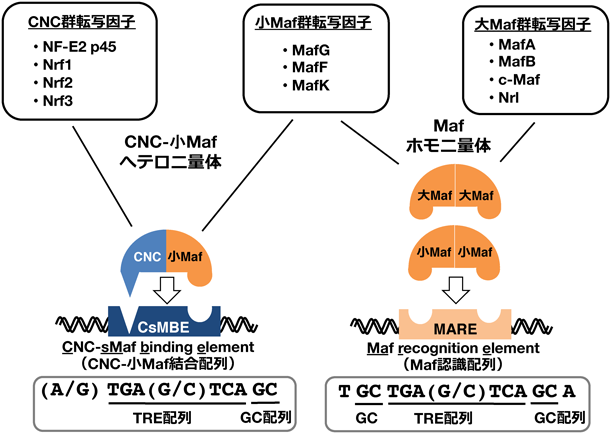
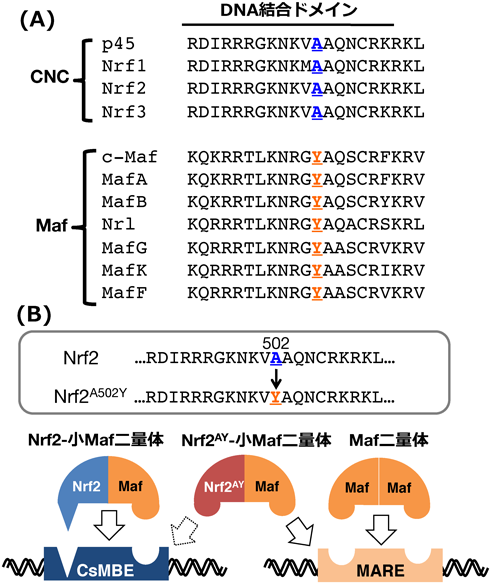
CNC-小Maf二量体による特殊なシス配列認識がつかさどる多様な生理的機能CNC-small Maf heterodimer: Unique cis-element recognition and biological functions
1 東北医科薬科大学医学部医化学教室Devision of Medical Biochemistry, Faculty of Medicine, Tohoku Medical and Pharmaceutical University ◇ 〒981–8558 宮城県仙台市青葉区小松島4丁目4–1 ◇ 4–4–1, Komatsushima, Aoba-ku, Sendai, Miyagi 981–8558, Japan
2 東北大学大学院医学系研究科医化学分野Department of Medical Biochemistry, Tohoku University Graduate School of Medicine ◇ 〒980–8575 宮城県仙台市青葉区星陵町2–1 ◇ 2–1 Seiryo-machi, Aoba-ku, Sendai, Miyagi 980–8575, Japan