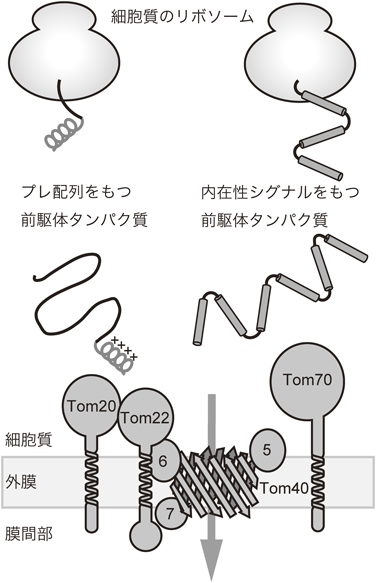
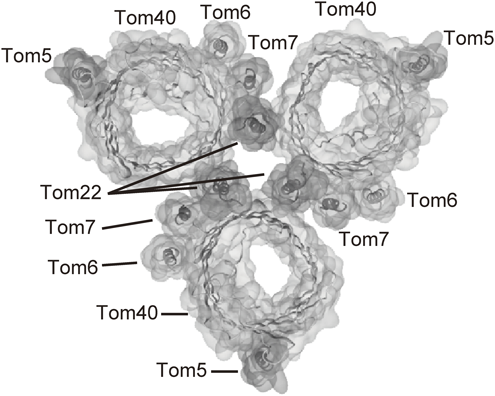
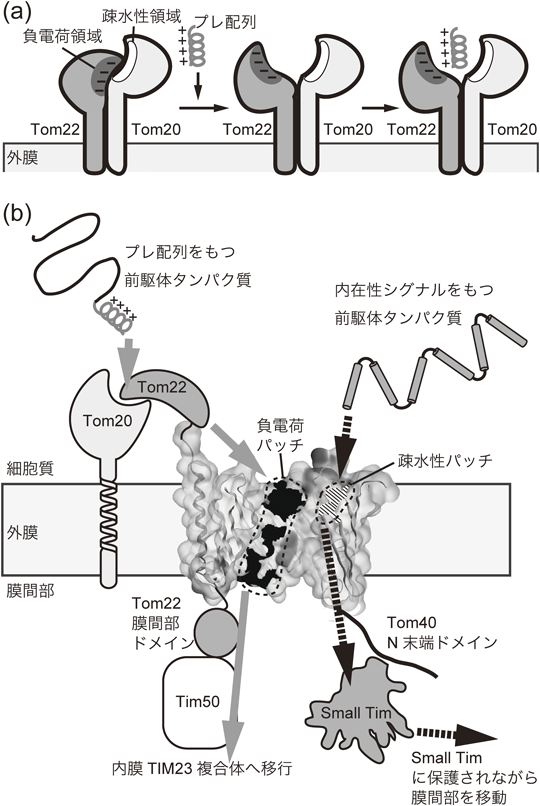
ミトコンドリアタンパク質搬入孔,TOM複合体の分子形態と機能Molecular architecture and function of mitochondrial protein entry gate
Monash大学微生物学部Lithgow Lab, Infection and Immunity Program, Biomedicine Discovery Institute and Department of Microbiology, Monash University ◇ Wellington Rd & Blackburn Rd, Clayton VIC 3800, Australia ◇ Wellington Rd & Blackburn Rd, Clayton VIC 3800, Australia