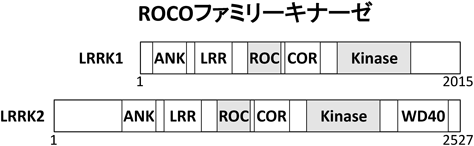
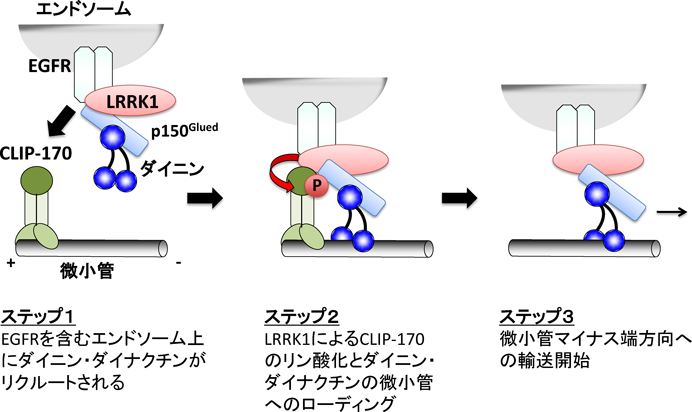
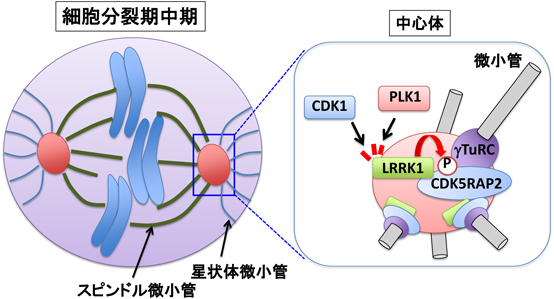
ROCOファミリーキナーゼLRRK1の基質依存的な細胞機能Regulation of cellular function by ROCO family kinase LRRK1 in a manner dependent on its substrates
名古屋大学大学院理学研究科生命理学専攻Department of Molecular Biology, Graduate School of Science, Nagoya University ◇ 〒464–8602 愛知県名古屋市千種区不老町 ◇ Chikusa-ku, Nagoya, Aichi 464–8602, Japan