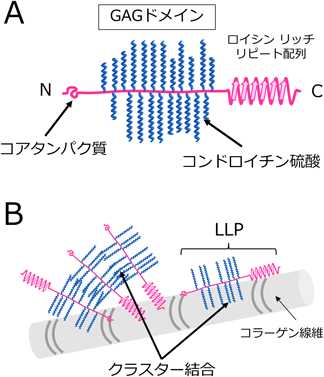
コラーゲンとの結合特異性にも関与する糖鎖のクラスター効果Chondroitin sulfate cluster involves in the binding specificity to collagen
弘前大学大学院医学研究科附属高度先進医学研究センター糖鎖工学講座Department of Glycotechnology, Center for Advanced Medical Research, Hirosaki University Graduate School of Medicine ◇ 〒036–8562 青森県弘前市在府町5 ◇ 5 Zaifu-cho, Hirosaki, Aomori 036–8562, Japan