1)赤血球造血の場
赤血球造血は,動物種によって異なり,かつ,個体の発生に伴って変化する.ヒトの造血の場は,卵黄嚢に始まり中腎領域(aorta-gonad-mesonephros:AGM)に移り,肝造血を経て最終的に骨髄に落ち着く.卵黄嚢を一次造血,肝造血以降を二次造血という.造血の場の変遷の発生学的詳細については,他書を参照していただきたい21–24).以前は,一次造血および肝造血で産生された赤血球は有核だとされていたが,これらの初期の造血での赤血球も無核(脱核している)であることが明らかになっている21–24).
2)赤芽球が脱核をする環境
骨髄環境での赤芽球は脱核するまではマクロファージ(Mϕ)と接着しており,これを赤芽球島という25–29).Mϕは,赤芽球の脱核までの場を確保するとともに,ヘム合成に必要な鉄分の供給や脱核によって排出された核のすばやい処理を行う2).赤芽球とMϕは双方に発現するerythroblast macrophage protein(Emp)により結合する30).さらに,赤芽球とMϕの結合にはα4β1 integrin(赤芽球側)とvascular cell adhesion molecule-1(VCAM-1, Mϕ側),intercellular adhesion molecule-4(ICAM-4,赤芽球側)とαV integrin(Mϕ側)が関与している2).細胞外マトリックスを構成するfibronectinやlamininも赤芽球や網状赤血球の終末分化を調節すると考えられている2).たとえば,赤芽球に発現するα4β1 integrinはfibronectinとも結合してアポトーシスを回避していると考えられている31).
では,Mϕとの結合は赤芽球の脱核に直接作用するのか,つまり,Mϕは赤芽球の終末分化に必要であっても脱核に対して直接関与しているかどうかが疑問になる.脱核後の核は膜様構造物で網状赤血球の細胞膜とつながっているが,血流やMϕの貪食などによる物理的な力によって分断されると考えられている.マウス脾から分離された赤芽球はMϕとの接着なしに正常に脱核する2).脱核した核は網赤血球から離別した後,Mϕが核表面(核を覆っている細胞膜)の「eat me」シグナルであるホスファチジルセリン(PS)を認識して貪食することが示された32).筆者らのグループは,ヒト末梢血由来の赤芽球がMϕや遠心分離やピペット操作による機械的外力がなくても脱核すること,脱核に要する時間はおおよそ8分前後であることを明らかにした33).これらの実験的観察は,赤芽球の脱核は細胞に内在する機構によって起こり,脱核におけるMϕの主要な役割は脱核後の核の速やかな処理であると考えるのが妥当であろう.もし,分離された核がMϕに貪食されなければ,TNF(腫瘍壊死因子)やIFN-β(インターフェロンβ)による慢性関節炎などの自己免疫疾患誘発が懸念される.
3)脱核までの動的変化(増殖・核濃縮・細胞極性化・脱核)
赤芽球の増殖から成熟赤血球に至る分化過程には,この細胞ならではのユニークなプロセスがある22–26).造血幹細胞から骨髄系幹細胞(骨髄系前駆細胞),赤血球・巨核球系前駆細胞,前期赤芽球系前駆細胞(burst-forming unit-erythroid:BFU-E),後期赤芽球系前駆細胞(colony-forming unit-erythrocyte:CFU-E),前赤芽球までに数回の細胞分裂をするがその後停止し,好塩基性赤芽球,多染性赤芽球,正染性赤芽球,網赤血球を経て赤血球に成熟する.この過程でオルガネラの空間的配置も変化する.細胞質基質での主体はヘモグロビンの産生であるが,その他にもリボソームの減少や細胞膜骨格の構築,微小構造の再構成などが起こる.正染性赤芽球では,核が細胞質の一方に偏在して細胞が極性化し,収縮環の収縮によって脱核する34).
一般的には,脱核する前の正染性赤芽球までを「赤芽球」と称されることが多く,本稿でも便宜的にCFU-Eから脱核までを赤芽球として扱っている.また,本稿ではこの間を終末分化(terminal differentiation)と呼ぶことにする.放出された核は細胞膜に覆われている事実から,赤芽球の脱核は極度な不均等細胞質分裂であると考えられており,事実,上皮細胞等の細胞質分裂で働くタンパク質が脱核に関わっていることがある23, 35).その一方で,細胞質分裂を制御する分子であるPar3などは赤芽球の脱核には関与しないことが報告されている36).
4)赤芽球の終末分化の分子基盤
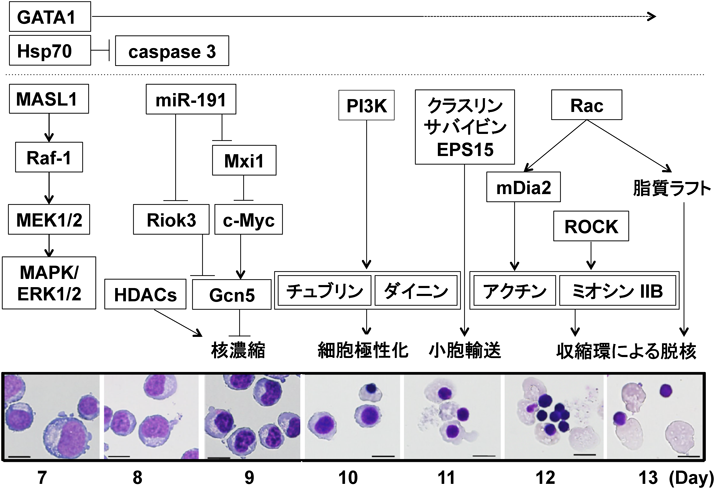
赤芽球の終末分化では,細胞増殖,核濃縮,細胞極性化,脱核とともに形態,オルガネラの空間配置や膜骨格構成も変化することから,関わる分子群も変化する(図1).
a. 核濃縮
脱核前の特徴的なイベントの一つに核濃縮がある37–39).マウス胎仔肝由来赤芽球に発現するhistone deacetylase(HDAC)アイソザイム(1, 2, 3, 5)の中でHDAC2がクロマチン凝集と脱核に関与することが,HDACの阻害剤であるトリコスタチンA(trichostatin A)を用いて明らかにされた40).また,クロマチン凝集と脱核はc-Mycによって抑制される41).c-Mycの過剰発現により,histone acetyltransferase(HAT)のアイソザイムであるGcn5による核濃縮とヒストンの脱アセチル化が抑制された42).また,Gcn5の発現は,miR-191によりRIO kinase 3(Riok3)とMax interacting protein 1(Mxi1)の発現制御を介して抑制される42).
tight junctionの主要タンパク質の一つであるClaudin 13(Cldn13)はマウス赤血球造血において,赤芽球脱核前に起こる核の偏在(細胞極性化)に関わると考えられている43).
マウスの系で,小胞輸送関連分子の阻害による赤芽球の脱核の抑制と,クラスリン(clathrin)およびアポトーシス抑制タンパク質であるサバイビンとその結合タンパク質であるEPS15(epidermal growth factor receptor substrate 15)の発現抑制による脱核率の低下が示されたことから,脱核部位への小胞輸送による空胞形成の関与が示された44, 45).核は細胞膜に取り囲まれて出ていくことから,減少した膜成分の補償に使われるのかもしれないが実験的検証はない35).
b. オルガネラ
マウス赤芽球では,脱核直前に核近傍に中心体が局在し,紡錘糸形成の阻害剤であるコルセミドの投与(1.5時間)により核と細胞質の形態的な変形を誘導したことから,中心体とチュブリンの脱核への関与が示唆された46).しかし,その後の研究により,チュブリンそのものが脱核に直接関与する可能性はほとんどないことが示された47).我々は,ヒト赤芽球において中心体が核近傍に局在することを確認し,また,β-チュブリンのタンパク質レベルでの発現はCFU-Eから脱核にかけて減少する傾向があることを報告した47, 48).しかし,微小管は,脱核の直前に核を細胞膜近傍へ移動させるために必要であった.細胞質モータータンパク質であるダイニンとキネシンの一種であるEg5(ヒト赤芽球で発現)をそれぞれの阻害剤によって阻害すると,CFU-Eの増殖は抑制されたが脱核が阻害されたのはdyneinが阻害されたときだけでEg5の阻害は脱核には影響しなかった47, 48).また,ダイニンのATPase阻害剤[erythro-9-(2-hydroxy-3-nonyl)adenine:EHNA]は,脱核直前で核近傍にあるダイニンの中心体への局在を阻害して核の偏在を抑制した48).なお,中心体分離・紡錘体形成に関わるAurora kinase AとAurora kinase Bを阻害すると,CFU-Eの増殖はともに抑制されたが脱核には影響しなかった.これは,Aurora kinaseのタンパク質レベルの発現自体が減少することによると考えられる48).
ヒト赤芽球では核の偏在化にダイニンが関わることを報告したが,マウスでは大きく異なる49).マウスではダイニンがTrim58(E3ユビキンチンリガーゼ)によるユビキンチン化を受けて消化されることで(実験的証明),核が未解明のキネシンによって偏在化することが報告された49).事実,マウス赤芽球では分化に従ってダイニンのタンパク質レベルでの発現が減少するが,Trim58をノックダウンした細胞ではダイニンは一定の発現を示した.ヒト赤芽球では,終末分化の間恒常的にTrim58の発現がタンパク質レベルで確認されたが,ダイニンの発現(タンパク質レベル)には顕著な変化がなかった.つまり,ヒトではダイニンが細胞極性(核の偏在)に関わっているが,マウスでは異なる未知のメカニズムが存在すると考えられる.一方,タンパク質脱リン酸化酵素の阻害も同様に脱核には影響しなかったことから,脱核に至る終末分化では脱核に関わらない情報伝達経路のタンパク質の発現自体に抑制や停止が起きていると考えられる.
核の偏在化は微小管依存性で局在性のあるphosphoinositide 3-kinase(PI3K)が調節していると考えられる50).マウスの赤芽球で,PI3Kの生成物であるホスファチジルイノシトール3,4-ビスリン酸とホスファチジルイノシトール3,4,5-トリスリン酸は,脱核前に核細胞膜の細胞質側に蓄積していることが確かめられた50).また,PI3Kの阻害による脱核の遅延や核偏在化の消失がマウスとヒトの赤芽球で確認されている48, 50).
本文ではことさらにヒトとマウスを区別しているが,赤芽球と赤血球はこれらの両者間で異なることが多く,この分野の研究ではマウスでの実験結果が直接ヒトに当てはまらないことが多い.実際にヒトとマウスでは,血圧と心拍数が異なり赤血球の寿命も異なる51).
c. 収縮環
脱核の最終段階は収縮環(アクトミオシン)の収縮による34).また,脱核におけるアクチン重合の制御分子としてRho GTPaseが同定されており,Rho GTPaseを阻害剤で阻害すると脱核しなくなった52).マウスでは,Rac GTPaseの下流分子であるmDia2の発現を抑制すると後期赤芽球脱核の収縮環形成と脱核が抑制された52).また,脱核時網状赤血球側の分裂溝に形成される脂質ラフト(lipid raft)の形成が阻害されると脱核が抑制された53).Ubukawaらは,ヒト造血幹細胞から分化誘導した赤芽球の脱核におけるミオシン分子種を同定した47).非筋型ミオシンII重鎖(non-muscle myosin heavy chain II:NMHC II)にはIIA, IIB, IICの三つのアイソフォームがある23).ヒト赤芽球にはNMHC IIA, IIBが発現しているが,IICは発現していなかった.NMHC IIAもしくはIIBをアイソフォーム特異的に阻害すると,NMHC IIB阻害のみが脱核を抑制したことから,脱核には非筋型IIBが収縮環の収縮機能を果たしていることが明らかになった47).
d. 転写因子
赤芽球の分化誘導は,erythropoietin(EPO)刺激によるJAK/STAT系によるGAT A転写因子群(GAT A1とGAT A2)の転写活性による54, 55).EPOは,マウスでは腎臓の神経堤細胞において低酸素誘導因子(HIF)により産生される56, 57).EPOの産生される臓器(組織)は動物種によって異なる.たとえば,アフリカツメガエル(Xenopus laeves)では,EPOは肺と肝臓で産生され,主要な赤血球造血器官は肝臓である58, 59).加藤らは,下等脊椎動物においてEPOが神経細胞保護作用や赤血球(赤芽球)前駆細胞のアポトーシス回避作用などの非造血作用をも有するが,哺乳類では赤血球造血に機能特化したことが,進化の過程で酸素要求度が向上したことに関係すると指摘している20).
ヒトとマウスの赤芽球の終末分化では,GAT A1の発現は必須であるが同時にクロマチン凝集も始まる.活性化されたcaspase-3による分解から核内のGAT A1を保護するためにHsp70が発現することが明らかにされた60, 61).
e. その他
赤芽球の核は収縮環(アクトミオシン)の収縮によって分離される.その他のオルガネラでは,ミトコンドリアがオートファジー(マイトファジー)によって脱核後,網状赤血球で処分されることがわかっている62, 63).これは,ヘム合成経路の一部がミトコンドリアで行われることを考慮すると,ヘモグロビン合成の時間をできる限り長くとっているように思われる64).
一方,網状赤血球からHsc70などシャペロンを含んだエクソソームがin vitroで観察されている65).生理的な役割は詳細な検討が必要であるが,免疫との関連が示唆されている66).
CD34+細胞からEPOによる赤芽球系細胞の分化・増殖にleucine-rich tandem repeats 1(MASL1)から始まるRaf-1, MEK1/2, ERK1/2の情報伝達が必要であることが示された67).MASL1は成熟赤血球にも検出されるが,単なる遺存の可能性もある.
マウスの系で,iPS細胞から成熟赤血球への分化誘導が試みられている68).iPS化に必要なc-Mycは,赤芽球の増殖にも必要だが脱核に向けて発現が減少する69).iPS細胞でもc-Mycの発現抑制による増殖の低下とともに,ヘム合成までは確認されている.しかし,in vitroでは脱核率が低いことからこの段階(正染赤芽球)でマウスに戻すと脱核することが確認されている70).
5)赤芽球脱核の意義
a. 仮説とその問題点
一般的に,無核の赤血球は哺乳類特有と思われているが例外もある.サラマンダー(Batrachosep,陸生傾向の強い有尾両生類)の中には,無核の赤血球を有する種がいる71).また,先述のとおり,赤血球の本格的な登場は脊椎動物であるが,実際にはヘモグロビンを内包する細胞を持つ無脊椎動物も確認されている3, 10).
赤芽球が脱核して,オルガネラのない赤血球が生じることの生体における有利性についていくつかの仮説が提唱されている72).第一に「酸素運搬の高効率化」である.哺乳類の中凹円盤状(biconcave)形態は,球体の中で最も表面積/体積比が大きくなる一方,核を含むオルガネラを排出した空間はすべてヘモグロビンに置き換えられる.第二に変形能の高度化であり,毛細血管の通過による形状の変化と復元を考えると,核をなくすことで,いわば「形状記憶細胞」に徹した方が120日間に20~30万回,総延長約10万kmを循環するのだから合理的である2).しかし,毛細血管の通過は哺乳類に限ったことではない.また,胎盤との関係を指摘する研究者もいるが,胎盤は軟骨魚類にもみられるし,進化学上胎盤を獲得した哺乳類の登場と無核赤血球の登場の時間的関係を説明する証拠がない.もう一つの興味深い仮説は,がん化の回避である.遺伝子変異によるがん化した赤血球が毎日2000億個も産生されたらあっという間に個体は死に至るだろう2, 72).確かに,排出された核は即座にMϕに処理されることからすればありうることかもしれない2, 72).
b. エネルギー代謝から見た脱核の意義の考察
オルガネラのない赤血球のエネルギー代謝は嫌気的解糖による基質レベルのリン酸化によるが,筆者らはヒト赤芽球のエネルギー産生も同様に嫌気的解糖によることを観察した73).興味深いことに,細胞分裂状態にあるCFU-E以降もミトコンドリアマトリックスに局在するピルビン酸脱水素酵素(PDH)のセリン残基(300番目)がリン酸化され,クエン酸回路が閉ざされたままになっていると考えられる73, 74).
ヒトとマウスの赤芽球のGlut1(グルコーストランスポーター1)によるグルコースの取り込みが,stomatin(ストマチン)の細胞膜の発現の増加に伴い減少することが報告された75).実際に細胞内のATP量は,脱核時には分裂時(CFU-E)の20%に低下した73).しかし,このATP量の減少は単にグルコースの取り込み抑制だけではなく,PDHのリン酸化,飢餓で活性化されるPDHリン酸化酵素(PDK)の継続的な発現による酸化的リン酸化の抑制による73).骨髄の酸素濃度は諸説あるがおおよそ5%以下の低酸素環境である76, 77).しかし,培養系でもこれらの低酸素適応に関連する分子がHIFαによって誘導されているかどうかは実験的に証明されてない.では,赤芽球の脱核のエネルギー獲得が酸化的リン酸化ではなく,嫌気的解糖によるエネルギー代謝を選択した背景は何か,哺乳類が誕生した中生代の環境から考察してみたい.
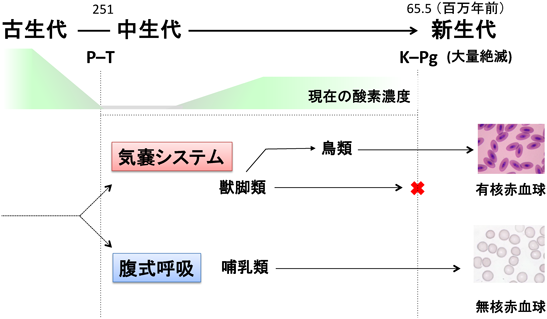
c. 中生代における低酸素適応との関連性
注目すべきことは,約2億5千万年前のペルム紀と三畳紀に起きた大量絶滅[(P–T境界(Permian–Triassic extinction event))後の中生代の低酸素環境下で,哺乳類と恐竜類が同時に進化したことだ78–80).この低酸素環境下(15%以下)で生き延びるために哺乳類は腹式呼吸を獲得したが,恐竜類は現存の鳥類のように肺に付属した気嚢という空気の貯留器官を手に入れた[気囊システム(airsac system)]78).気嚢システムによって,肺にはいつも新鮮な酸素が供給されるが,哺乳類の腹式呼吸は空気を吸ったり吐いたりの交互になっている(図2).インドガン(Anser indicus)やアネハヅル(Anthropoides virgo)が標高約8000 mのヒマラヤ上空を飛行し続けられるのも気嚢システムによると考えられ11, 12).中生代の約2億年の間,哺乳類は体長15 cm程度の大きさだった78).体が小さいことは寿命が短いことを示しており,世代交代が速く,つまり,進化速度が速いことを意味する.逆に巨大化した恐竜は寿命が長くなり,相対的に進化速度が遅くなったと思われる.哺乳類の祖先で,赤芽球が脱核する個体が誕生する確率は,恐竜類に比べて格段に高かったに違いない.ただし,哺乳類の祖先の化石が十分に発見されているわけではなく,無核赤血球の物的証拠(化石など)を見つけることは難しいだろう.
1)赤血球の大きさと数
両生類を除く脊椎動物(爬虫類,鳥類,哺乳類)441種類の平均赤血球容積(mean corpuscular volume:MCV)と単位体積あたりの赤血球数の関係が調べられ,生物進化にしたがって赤血球のサイズを小さくして数を増やした傾向があることがわかった81).また,36種類の無顎類を含む魚類でも同様な傾向があった82).以上の結果は,生物進化の中で赤血球のサイズを小さくして数を増やした傾向があるように思われる.しかし,この傾向の中で両生類には突出して大きいサイズの赤血球を持つ種がいるが,その理由はわかっていない82).
2)赤血球の形態と膜骨格構造
哺乳類の赤血球の基本形態はラクダを除けば中凹円盤状であるが,有核赤血球は核を中心部に保持するために楕円形である(図3).表面積/体積比は,中凹円盤状が最も大きくなることからガス交換効率は向上する.つまり,同じ体積ならば饅頭よりは白玉団子の方が表面積は大きくなる.これは哺乳類が赤血球から核をなくした利点の一つであり,また,サイズの小型化にも貢献したといえる.
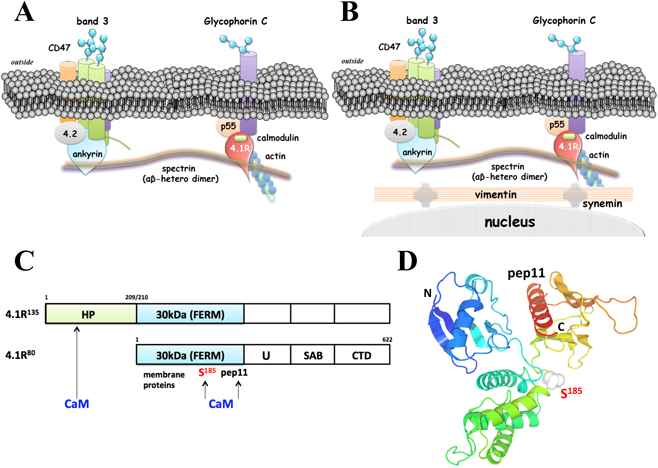
赤芽球の脱核を考える上で,赤血球膜の裏打ち構造も看過できない.赤血球膜赤血球裏打ち膜構造タンパク質はヒト赤血球膜の電気泳動法により解析され,また,細胞膜骨格構造とその構築過程は,最初にニワトリの赤血球で解析された83, 84).基本的な赤血球膜構骨格構造はヒト(無核)もニワトリ(有核)も似ている(図3).2種類の細胞膜貫通タンパク質でGlycophorin C(GPC)とband 3(anion exchanger 1)は,それぞれprotein 4.1Rとankyrinに結合している.protein 4.1Rはアクチン繊維とともに,ankyrinは直接に繊維状のspectrin αβのヘテロ二量体と結合して細胞膜を裏打ちしている85, 86).ヘテロ二量体のspectrinどうしは各々の末端部で結合して網目状構造を形成することで細胞膜構造を安定化する86).protein 4.1RのN-terminal 30 kDa domain(FERM domain:four one-ezrin- radexin-moesin domain)はそのA264KKLWKVCVEHHTFFRL配列でカルモジュリン(CaM)とCa2+非依存性に結合しているが,CaMがCa2+で飽和されると(Ca2+/CaM)S185残基との結合が強まり,膜貫通タンパク質およびspectrinとの結合が平衡解離定数で10倍程度弱まる87, 88).毛細血管内を通過するときに,膜骨格タンパク質間の結合を緩めることによって,細胞の形状変形をしやすくするためだと考えられる87).ただし,有核赤血球のprotein 4.1RはS185がプロリンやアラニンに置換されており,Ca2+/CaMの効果がない89).これは,血流速や血管の太さなどが関係していると思われる.では,脱核のようにオルガネラが抜け出るためには,平衡解離定数の10倍程度の変化では不十分であろうか.
protein 4.1Rは,選択的スプラインシングにより赤芽球に特徴的に発現する135 kDa型(4.1R135)と,赤芽球終末分化で発現し成熟赤血球膜骨格を構成する80 kDa型(4.1R80)がある90–92).4.1R135は4.1R80のN末端に209アミノ酸(head-piece:HP)が付加されており,HPにはCa2+依存性のCaM結合配列(S76 RGLSRLFSSFLKRPKS)がある91, 92).HPにCa2+/CaMが結合すると4.1R135の膜貫通タンパク質(band 3とGPC-p55複合体)への結合を完全に抑制するか,平衡解離定数で100倍程度弱める92).これは,4.1R80に対する作用,つまり,平衡解離定数で10倍程度の制御とはまったく異なる88, 92).脱核のときに,種々のリン酸化酵素の発現が低下や消失する中で,Ca2+/CaMによる4.1R135を介した制御系は有効であり,また,成熟赤血球での4.1R80の適度な結合・解離によって変形能を維持することは理にかなっていると思われる.赤芽球の脱核におけるCa2+の役割が報告され,CaMの阻害剤であるW-7によって脱核は抑制された93).ただし,この報告は,膜骨格ではなくCa2+によるシグナル伝達についての解析であり,実際の細胞内Ca2+濃度については明らかにされてない93).4.1R135は,アフリカツメガエルやニワトリの有核赤血球でも発現しており,CaM結合部位も保存されていることから,進化学的にはCa2+/CaMによる膜骨格の制御系だけでは説明できないことがあり,さらに詳細な解析が必要である94).
有核赤血球,たとえばニワトリの赤血球では,中間径フィラメントを形成する2種類のタンパク質,ビメンチン(vimentin)とシネミン(synemin)によって核が固定されている(図3)83, 84).しかし,ニワトリやヤツメウナギなどの有核赤血球において,これらのタンパク質が結合する細胞膜骨格タンパク質についてさらに詳細な解析が必要である95).ニワトリ赤血球も哺乳類同様に赤芽球の段階で核濃縮が起り,オルガネラの消化を行うことでヘモグロビン量の増大を図っている.脱核するかしないかの違いがあるだけである.なお,有核赤血球の核の遺伝子発現については異論があり,さらに詳細な検討を要する96).
引用文献References
1) Bianconi, E., Piovesan, A., Facchin, F., Beraudi, A., Casadei, R., Frabetti, F., Vitale, L., Pelleri, M.C., Tassani, S., Piva, F., Perez-Amodio, S., Strippoli, P., & Canaider, S. (2013) Ann. Hum. Biol., 40, 463–471.
2) Chasis, J.A. & Mohandas, N. (2008) Blood, 112, 470–478.
3) Glomski, C.A. & Pica, A. (2006) Erythrocytes of the Poikilotherms: A phylogenetic odyssey, Foxwell & Davies Limited., UK.
4) Vinogradov, S.N. (1985) Comp. Biochem. Physiol. B, 82, 1–15.
5) Glomski, C.A. & Tamburlin, J. (1989) Histol. Histopathol., 4, 509–514.
6) Weber, R.E. & Vinogradov, S.N. (2001) Physiol. Rev., 81, 569–628.
7) Royer, W.E. Jr., Zhu, H., Gorr, T.A., Flores, J.F., & Knapp, J.E. (2005) J. Biol. Chem., 280, 27477–27480.
8) Gow, A.J., Payson, A.P., & Bonaventura, J. (2005) J. Inorg. Biochem., 99, 903–911.
9) Flores, J.F., Fisher, C.R., Carney, S.L., Green, B.N., Freytag, J.K., Schaeffer, S.W., & Royer, W.E. Jr. (2005) Proc. Natl. Acad. Sci. USA, 102, 2713–2718.
10) Furuta, H., Ohe, M., & Kajita, A. (1977) J. Biochem., 82, 1723–1730.
11) Storz, J.F. (2016) J. Exp. Biol., 219, 3190–3203.
12) Mairbäurl, H. & Weber, R.E. (2012) Compr. Physiol., 2, 1463–1489.
13) Beers, J.M. & Jayasundara, N. (2015) J. Exp. Biol., 218, 1834–1845.
14) Cheng, C.H. & Detrich, H.W. 3rd. (2007) Philos. Trans. R. Soc. Lond. B Biol. Sci., 362, 2215–2232.
15) di Prisco, G., Cocca, E., Parker, S., & Detrich, H. III. (2002) Gene, 295, 185–191.
16) Near, T.J., Parker, S.K., & Detrich, H.W. 3rd. (2006) Mol. Biol. Evol., 23, 2008–2016.
17) 布村 渉,澤田賢一(2012)血液フロンティア,22, 86–89.
18) Maekawa, S., Iemura, H., Kuramochi, Y., Nogawa-Kosaka, N., Nishikawa, H., Okui, T., Aizawa, Y., & Kato, T. (2012) J. Exp. Biol., 215, 3087–3095.
19) Maekawa, S. & Kato, T. (2015) BioMed Res. Int., 2015, 747052.
20) 加藤尚志,前川 峻,永沢和道,奥井武仁,谷崎裕太(2016)臨床血液,57, 925–949.
21) Baron, M.H., Isern, J., & Fraser, S.T. (2010) Blood, 119, 4828–4837.
22) Palis, J., Malik, J., McGrath, K.E., & Kingsley, P.D. (2010) Int. J. Dev. Biol., 54, 1011–1018.
23) 鵜生川久美,澤田賢一(2012)日本内科学会雑誌,101, 2002–2009.
24) 杉山大介,田中由香,湯岑綾子,小島直子(2016)臨床血液,57, 944–932.
25) Migliaccio, A.R. (2010) Haematologica, 95, 1985–1988.
26) Keerthivasan, G., Wickrema, A., & Crispino, J.D. (2011) Stem Cells Int., 2011, 139851.
27) Giger, K.M. & Kalfa, T.A. (2015) BioMed Res. Int., 2015, 873628.
28) Hom, J., Dulmovits, B.M., Mohandas, N., & Blanc, L. (2015) Immunol. Res., 63, 75–89.
29) Jacobsen, R.N., Perkins, A.C., & Levesque, J.P. (2015) Curr. Opin. Hematol., 22, 212–219.
30) Soni, S., Bala, S., Gwynn, B., Sahr, K.E., Peters, L.L., & Hanspal, M. (2006) J. Biol. Chem., 281, 20181–20189.
31) Eshghi, S., Vogelezang, M.G., Hynes, R.O., Griffith, L.G., & Lodish, H.F. (2007) J. Cell Biol., 177, 871–880.
32) Yoshida, H., Kawane, K., Koike, M., Mori, Y., Uchiyama, Y., & Nagata, S. (2005) Nature, 437, 754–758.
33) Hebiguchi, M., Hirokawa, M., Guo, Y.M., Saito, K., Wakui, H., Komatsuda, A., Fujishima, N., Takahashi, N., Takahashi, T., Sasaki, T., Nunomura, W., Takakuwa, Y., & Sawada, K. (2008) Int. J. Hematol., 88, 498–507.
34) Koury, S.T., Koury, M.J., & Bondurant, M.C. (1989) J. Cell Biol., 109, 3005–3013.
35) Bell, A.J., Satchwell, T.J., Heesom, K.J., Hawley, B.R., Kupzig, S., Hazell, M., Mushens, R., Herman, A., & Toye, A.M. (2013) PLoS ONE, 8, e60300.
36) Wölwer, C.B., Gödde, N., Pase, L.B., Elsum, I.A., Lim, K.Y., Sacirbegovic, F., Walkley, C.R., Ellis, S., Ohno, S., Matsuzaki, F., Russell, S.M., & Humbert, P.O. (2017) PLoS ONE, 12, e0170295.
37) Zhao, B., Yang, J., & Ji, P. (2016) Nucleus, 7, 425–429.
38) Zhao, B., Mei, Y., Schipma, M.J., Roth, E.W., Bleher, R., Rappoport, J.Z., Wickrema, A., Yang, J., & Ji, P. (2016) Dev. Cell, 36, 498–510.
39) Baron, M.H. & Barminko, J. (2016) Dev. Cell, 36, 481–482.
40) Ji, P., Yeh, V., Ramirez, T., Murata-Hori, M., & Lodish, H.F. (2010) Haematologica, 95, 2013–2021.
41) Jayapal, S.R., Lee, K.L., Ji, P., Kaldis, P., Lim, B., & Lodish, H.F. (2010) J. Biol. Chem., 285, 40252–40265.
42) Zhang, L., Flygare, J., Wong, P., Lim, B., & Lodish, H.F. (2011) Genes Dev., 25, 119–124.
43) Thompson, P.D., Tipney, H., Brass, A., Noyes, H., Kemp, S., Naessens, J., & Tassabehji, M. (2010) PLoS One, 5, e12667.
44) Keerthivasan, G., Small, S., Liu, H., Wickrema, A., & Crispino, J.D. (2010) Blood, 116, 3331–3341.
45) Keerthivasan, G., Liu, H., Gump, J.M., Dowdy, S.F., Wickrema, A., & Crispino, J.D. (2012) Haematologica, 97, 1471–147.
46) Skutelsky, E. & Danon, D. (1970) Exp. Cell Res., 60, 427–436.
47) Ubukawa, K., Guo, Y.M., Takahashi, M., Hirokawa, M., Michishita, Y., Nara, M., Tagawa, H., Takahashi, N., Komatsuda, A., Nunomura, W., Takakuwa, Y., & Sawada, K. (2012) Blood, 119, 1036–1044.
48) Kobayashi, I., Ubukawa, K., Sugawara, K., Asanuma, K., Guo, Y.M., Yamashita, J., Takahashi, N., Sawada, K., & Nunomura, W. (2016) Exp. Hematol., 44, 247–256.
49) Thom, C.S., Traxler, E.A., Khandros, E., Nickas, J.M., Zhou, O.Y., Lazarus, J.E., Silva, A.P., Prabhu, D., Yao, Y., Aribeana, C., Fuchs, S.Y., Mackay, J.P., Holzbaur, E.L., & Weiss, M.J. (2014) Dev. Cell, 30, 688–700.
50) Wang, J., Ramirez, T., Ji, P., Jayapal, S.R., Lodish, H.F., & Murata-Hori, M. (2012) J. Cell Sci., 125, 340–349.
51) Synyder, G.K. & Sheafor, B.A. (1999) Am. Zool., 39, 189–198.
52) Ji, P., Jayapal, S.R., & Lodish, H.F. (2008) Nat. Cell Biol., 10, 314–332.
53) Konstantinidis, D.G., Pushkaran, S., Johnson, J.F., Cancelas, J.A., Manganaris, S., Harris, C.E., Williams, D.A., Zheng, Y., & Kalfa, T.A. (2012) Blood, 119, 6118–6127.
54) Shimizu, R. & Yamamoto, M. (2016) Exp. Hematol., 44, 696–705.
55) Nogueira-Pedro, A., dos Santos, G.G., Oliveira, D.C., Hastreiter, A.A., & Fock, R.A. (2016) Front. Biosci., 8, 100–112.
56) Tanaka, M., Asada, M., Higashi, A.Y., Nakamura, J., Oguchi, A., Tomita, M., Yamada, S., Asada, N., Takase, M., Okuda, T., Kawachi, H., Economides, A.N., Robertson, E., Takahashi, S., Sakurai, T., Goldschmeding, R., Muso, E., Fukatsu, A., Kita, T., & Yanagita, M. (2010) J. Clin. Invest., 120, 768–777.
57) Souma, T., Suzuki, N., & Yamamoto, M. (2015) Front. Physiol., 6, 167.
58) Nogawa-Kosaka, N., Hirose, T., Kosaka, N., Aizawa, Y., Nagasawa, K., Uehara, N., Miyazaki, H., Komatsu, N., & Kato, T. (2010) Exp. Hematol., 38, 363–372.
59) Okui, T., Hosozawa, S., Kohama, S., Fujiyama, S., Maekawa, S., Muto, H., & Kato, T. (2016) Zoolog. Sci., 33, 575–582.
60) Hermine, O., Arlet, J.B., Ribeil, J.A., Guillerm, F., Vandekerkhove, J., & Courtois, G. (2013) Transfus. Clin. Biol., 20, 144–147.
61) Ribeil, J.A., Zermati, Y., Vandekerckhove, J., Cathelin, S., Kersual, J., Dussiot, M., Coulon, S., Moura, I.C., Zeuner, A., Kirkegaard-Sørensen, T., Varet, B., Solary, E., Garrido, C., & Hermine, O. (2007) Nature, 445, 102–105.
62) Mortensen, M., Ferguson, D.J., & Simon, A.K. (2010) Cell Cycle, 9, 1901–1906.
63) Mortensen, M., Ferguson, D.J., Edelmann, M., Kessler, B., Morten, K.J., Komatsu, M., & Simon, A.K. (2010) Proc. Natl. Acad. Sci. USA, 107, 832–837.
64) Fujiwara, T. & Harigae, H. (2015) BioMed Res. Int., 2015, 278536.
65) Carayon, K., Chaoui, K., Ronzier, E., Lazar, I., Bertrand-Michel, J., Roques, V., Balor, S., Terce, F., Lopez, A., Salomé, L., & Joly, E. (2011) J. Biol. Chem., 286, 34426–34439.
66) Bobrie, A., Colombo, M., Raposo, G., & Théry, C. (2011) Traffic, 12, 1659–1668.
67) Kumkhaek, C., Aerbajinai, W., Liu, W., Zhu, J., Uchida, N., Kurlander, R., Hsieh, M.M., Tisdale, J.F., & Rodgers, G.P. (2013) Blood, 12, 3216–3227.
68) Hirose, S., Takayama, N., Nakamura, S., Nagasawa, K., Ochi, K., Hirata, S., Yamazaki, S., Yamaguchi, T., Otsu, M., Sano, S., Takahashi, N., Sawaguchi, A., Ito, M., Kato, T., Nakauchi, H., & Eto, K. (2013) Stem Cell Rep., 1, 499–508.
69) Takayama, N., Nishimura, S., Nakamura, S., Shimizu, T., Ohnishi, R., Endo, H., Yamaguchi, T., Otsu, M., Nishimura, K., Nakanishi, M., Sawaguchi, A., Nagai, R., Takahashi, K., Yamanaka, S., Nakauchi, H., & Eto, K. (2010) J. Exp. Med., 207, 2817–2830.
70) 廣瀬正一(2014)血液フロンティア,24, 63–69.
71) Mueller, R.L., Gregory, T.R., Gregory, S.M., Hsieh, A., & Boore, J.L. (2008) Zoology (Jena), 111, 218–230.
72) 鵜生川久美(2014)血液フロンティア,24, 55–61.
73) Kobayashi, I., Sugawara, K., Goto, T., Asanuma, K., Yamashita, J., Ubukawa, K., Guo, Y.M., Takahashi, N., Wakui, H., Sawada, K., & Nunomura, W.(2016) Regulation of ATP production during terminal differentiation of human erythropoiesis. 12th International Congress of Cell Biology (ICCB), Prague Congress Centre, Czech Republic, P319 (Program & Abstract Book, p286).
74) Jeoung, N.H. (2015) Diabetes Metab. J., 39, 188–197.
75) Montel-Hagen, A., Kinet, S., Manel, N., Mongellaz, C., Prohaska, R., Battini, J.L., Delaunay, J., Sitbon, M., & Taylor, N. (2008) Cell, 132, 1039–1048.
76) Nombela-Arrieta, C., Pivarnik, G., Winkel, B., Canty, K.J., Harley, B., Mahoney, J.E., Park, S.Y., Lu, J., Protopopov, A., & Silberstein, L.E. (2013) Nat. Cell Biol., 215, 533–543.
77) Spencer, J.A., Ferraro, F., Roussakis, E., Klein, A., Wu, J., Runnels, J.M., Zaher, W., Mortensen, L.J., Alt, C., Turcotte, R., Yusuf, R., Côté, D., Vinogradov, S.A., Scadden, D.T., & Lin, C.P. (2014) Nature, 508, 269–273.
78) Ward, P.D.(2006) Out of Thin air, Joseph Henry Press, USA.
79) Svensmark, H. (2007) Astron. Geophys., 48, 1.18–1.24.
80) NHK恐竜プロジェクト編,小林快次監修(2006)恐竜VSほ乳類,ダイヤモンド社.
81) Hawkey, C.M., Bennett, P.M., Gascoyne, S.C., Hart, M.G., & Kirkwood, J.K. (1991) Br. J. Haematol., 77, 392–397.
82) 布村 渉,澤田賢一(2014)血液フロンティア.24, 21–30.
83) Woods, C.M. & Lazarides, E. (1998) Annu. Rev. Med., 39, 107–122.
84) Granger, B.L., Repasky, E.A., & Lazarides, E. (1982) J. Cell Biol., 92, 299–312.
85) Fairbanks, G., Steck, T.L., & Wallach, D.F. (1971) Biochemistry, 10, 2606–2617.
86) Bennett, V. & Baines, A.J. (2001) Physiol. Rev., 81, 1353–1392.
87) Takakuwa, Y. & Mohandas, N. (1988) J. Clin. Invest., 82, 394–400.
88) Nunomura, W., Takakuwa, Y., Parra, M., Conboy, J., & Mohandas, N. (2000) J. Biol. Chem., 275, 6360–6367.
89) Nunomura, W., Takakuwa, Y., Cherr, G.N., & Murata, K. (2007) Comp. Biochem. Physiol. B Biochem. Mol. Biol., 148, 124–138.
90) Parra, M.K., Gee, S.L., Koury, M.J., Mohandas, N., & Conboy, J.G. (2003) Blood, 101, 4164–4171.
91) Nunomura, W., Gascard, P., & Takakuwa, Y. (2011) Int. J. Cell Biol., 2011, 943272.
92) Nunomura, W., Parra, M., Hebiguchi, M., Sawada, K., Mohandas, N., & Takakuwa, Y. (2009) Biochem. J., 417, 141–148.
93) Wölwer, C.B., Pase, L.B., Russell, S.M., & Humbert, P.O. (2016) PLoS ONE, 11, e0146201.
94) Kelly, G.M., Zelus, B.D., & Moon, R.T. (1991) J. Biol. Chem., 266, 12469–12473.
95) Hägerstrand, H., Danieluk, M., Bobrowska-Hägerstrand, M., Kralj-Iglic, V., Lindqvist, C., & Nikinmaa, M. (1999) Mol. Membr. Biol., 16, 195–204.
96) Morera, D., Roher, N., Ribas, L., Balasch, J.C., Doñate, C., Callol, A., Boltaña, S., Roberts, S., Goetz, G., Goetz, F.W., & MacKenzie, S.A. (2011) PLoS ONE, 6, e26998.
97) Schweitzer, M.H., Wittmeyer, J.L., Horner, J.R., & Toporski, J.B. (2005) Science, 307, 1952–1955.
98) Schweitzer, M.H., Wittmeyer, J.L., & Horner, J.R. (2007) Proc. Biol. Sci., 274, 183–197.
99) Bertazzo, S., Maidment, S.C., Kallepitis, C., Fearn, S., Stevens, M.M., & Xie, H.N. (2016) Nat. Commun., 6, 7352.
100) Krauss, S.W., Heald, R., Lee, G., Nunomura, W., Gimm, J.A., Mohandas, N., & Chasis, J.A. (2002) J. Biol. Chem., 277, 44339–44346.
101) Salomao, M., Zhang, X., Yang, Y., Lee, S., Hartwig, J.H., Chasis, J.A., Mohandas, N., & An, X. (2008) Proc. Natl. Acad. Sci. USA, 105, 8026–8031.
102) Nunomura, W., Wakui, H., Takakuwa, Y., & Gascard, P. (2013) J. Proteomics & Bioinformatics., S4, 004.
103) Han, B.G., Nunomura, W., Takakuwa, Y., Mohandas, N., & Jap, J.K. (2000) Nat. Struct. Biol., 7, 871–875.