各々の組織・臓器に構築される神経—血管ネットワークは,密接な相互作用を有しているが,その三次元パターンは無秩序ではなく,一定の法則に従って構築される.この神経—血管ネットワークは,中枢から分岐し,末梢に到達するまでに伴走することが知られており,動脈・静脈は神経支配を受け,神経も血管からの酸素供給がなければ生存しえない.つまり,両者には密接なワイヤリングが存在している.それでは,生体内で血管はどのように発生し,いかに恒常性の維持や多様な機能発現に関与しているのであろうか?
2. Neuro-Vascular Unitの概念でとらえる脳卒中
2001年に開催された米国NIHのStroke Progress Review Groupにおいて,脳卒中研究の状況を評価し,今後の方向性について議論がなされた.中でも,なぜ,多くの神経細胞保護薬が効果を示さないのかについて多くの議論がなされた結果,神経細胞という単一の細胞種にのみ着目するのは脳卒中治療として不十分であるという認識が明確となった.このため,脳卒中治療は神経細胞の保護に限定せず,周囲の細胞をも含めた包括的な脳保護治療を目指すべきであるとして,神経細胞,血管内皮細胞,アストロサイト,細胞外マトリックスからなる概念的な単位として,Neuro-Vascular Unitが提唱された1).
脳卒中は,脳梗塞,脳出血およびくも膜下出血の三つの病型を含む.脳梗塞は血管の狭窄や閉塞で生じる虚血性疾患で,脳出血やくも膜下出血は血管の破綻で生じる出血性疾患であり,日本のみならず先進国において主要な死亡原因の一つである.血管障害である脳卒中の病態を理解するためには,基礎的な血管生物学を理解することが必要不可欠であり,神経系と血管系のワイヤリングをより詳細に知ることが,脳卒中の病態を解明するためのブレイクスルーになると期待される.我々の以前の研究においても,脳卒中のモデル動物である脳卒中易発症ラット2)においては,高血圧を発症する以前の4週齢においても,すでに血管が物理的に脆いことを確認している3).つまり,高血圧による二次的な要因だけではなく,脳卒中を発症しやすい個体においては,血管組織の異常が,疾患を発症しやすい脆弱性基盤を一次的に作っている可能性が示唆される.
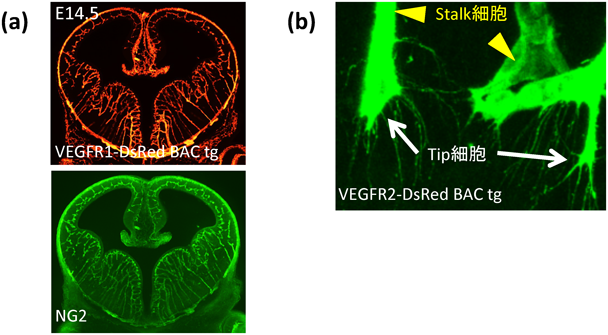
近年,成体哺乳類の脳においては,以前考えられていたよりも可塑性が高いことがわかっており,成体脳における神経新生は,血管内皮細胞との密接な関連性の中で生じることが指摘されている4).病態においても,脳梗塞後は神経幹細胞の分裂が促され5),回復過程にある脳では神経新生とともに血管系のリモデリングが複雑に関連する.また,灰白質では,血管内皮細胞と神経幹細胞が相互に関連性を持つことで血管新生と神経新生を調節している6, 7).一方,発生期の脳では,血管網(図1a)がきわめて規則的に発生し,神経発生と協調的に血管発生が進行することが,血管リポーターマウス8, 9)を用いた解析から明らかになっている(後述).こうした萌芽的な知見は,神経系と血管系のワイヤリングに注目することの重要性を示唆している.
脊椎動物は,血管と神経のネットワークをからだの隅々にまで発達させることによって,成体の恒常性の維持と多様な機能発現を可能にしている.これらの神経—血管二大ネットワークが形成されるとき,その三次元パターンは無秩序ではなく,一定の法則に従い,両者には密接な相互作用が存在している.神経—血管ワイヤリングの解剖学的考察は,すでに16世紀においてオランダ人の解剖学者Andreas Vesaliusによって記載されている10).この両者は中枢から分岐し,末梢に到達するまでに伴走することが知られており,血管平滑筋を伴う動脈・静脈は神経支配を受け,神経も血管からの酸素供給がなければ生存しえない.つまり,両者には密接なワイヤリングが存在している.それでは,組織・臓器において,血管はどのように発生するのであろうか?
血管系の発生プロセスは,脈管形成(vasculogenesis)と呼ばれる,血管内皮前駆細胞が集合して蜂の巣状の原始血管叢を形成する過程から始まる.続いて血管新生(angiogenesis)の過程において,組織構築に伴い低酸素に応答して原始血管叢が無血管領域へと浸潤し,発芽,分岐,融合を繰り返しながら,より複雑な毛細血管網を構築する.
原始血管叢の発芽領域では,成長中の血管の先端に位置する血管内皮細胞が,無数の糸状仮足(filopodia)を無血管領域に向けて伸展する.この糸状仮足を伸ばす血管内皮細胞をTip細胞(血管先端内皮細胞),その背後から増殖して血管伸長を支える血管内皮細胞をStalk細胞(血管柄細胞)と呼び,このStalk細胞ではTip細胞のような糸状仮足伸展が行われずに盛んな細胞増殖が起こることが知られている(図1b)11).Tip細胞の形態は,まさに神経軸索伸長における成長円錐に類似し,Tip細胞は無血管領域に発現する血管内皮成長因子(vascular endothelial growth factor:VEGF)の濃度勾配に応じて糸状仮足を伸ばしながら遊走し,血管成長の方向性を決定するとともに,血管の分岐数を規定している.一方,Stalk細胞は活発な増殖により後続する血管網の細胞数を規定している12).Tip細胞とStalk細胞は可塑性を保ちながら血管網を構築しており,Stalk細胞がTip細胞に変化することもあれば,逆にTip細胞が糸状仮足を退縮させてStalk細胞へと変化することもある.Tip細胞ではNotchリガンドであるDelta-like 4(Dll4)を発現する一方で,Stalk細胞ではNotch受容体であるNotch1が発現し,このDll4–Notch1シグナルによって,Tip細胞とStalk細胞の均衡と,Tip細胞の糸状仮足伸展を制御して血管密度を適正に維持している13).このため,Dll4ノックアウトマウスでは,Tip細胞から伸びる糸状仮足数が増加するとともに,Tip細胞とStalk細胞の比率が増加する結果,血管の成長速度は減少するが,血管の間隙が圧縮された過密な血管網が形成される.やがて,血流の出現とともに,組織に浸潤した原始血管叢がリモデリングと呼ばれる過程を経て,階層性のある成熟血管網が出現する.
このような複雑な血管網の構築が,どのように神経の発生・分化と協調して進行するのかについて,最近の研究を紹介していきたい.
5. 大動脈は,交感神経や運動神経の発生・分化を調節する
自律神経系は交感神経系と副交感神経系に大別され,生体の恒常性維持にきわめて重要な役割を担う.最近の研究で,この自律神経の発生における血管の関わりに関して,重要な研究が報告されている.
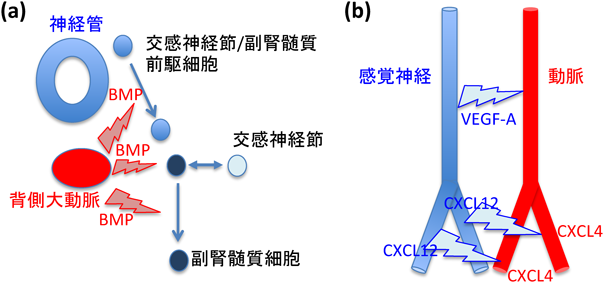
自律神経系の節後神経と副腎髄質の細胞は神経堤細胞に由来するが,交感神経節と副腎髄質の共通前駆細胞(sympatho-adrenal precursor:SA細胞)は,神経管から遊離した後,背側大動脈へ移動することが知られている.このとき,本来はSA細胞が移動しないルートに背側大動脈を移植すると,移植片周辺にSA細胞が集積することが確認されている.この背側大動脈は骨形成タンパク質(bone morphogenetic protein:BMP)を分泌しており14),この周辺組織ではSDF1(CXCL12)とNeuregulin 1の発現が促され,次に,これらの2種類の因子がSA細胞を誘引することで,SA細胞が背側大動脈まで移動することが明らかにされている15)(図2a).
背側大動脈までたどり着いたSA細胞は,やがて交感神経節と副腎髄質へと分離する(図2a).このとき,SA細胞は,BMPシグナルがオンの集団とオフの集団を含むことが見いだされており,リン酸化SMAD陽性細胞が副腎髄質細胞であることが明らかになっている.実際,背側大動脈でSA細胞特異的にBMPシグナルを阻害すると,交感神経節は正常に発生する一方で,副腎髄質細胞は完全に欠損することから,背側大動脈で発現するBMPシグナルが副腎髄質の発生に決定的な役割を果たすことが示唆されている15).
副腎髄質細胞は,その後,尾側へ移動を続けるが,この移動経路に沿ってNeuregulin 1を発現することが確認されており,Neuregulin 1が副腎髄質細胞の誘引因子であることが明らかになっている15).このNeuregulin 1の発現も背側大動脈から供給されるBMPによって調節されていることから,副腎形成の過程にも血管との関わりが重要な役割を果たす可能性が示唆される(図2a).しかしながら,これらの知見は限られた種類の交感神経系でのみ観察される現象であることから,今後,さらに血管との相互作用の詳細が明確化されることが期待される.
一方で,神経–血管伴走性を解析するために,ゼブラフィッシュは,胚が透明であること,発生が早く神経・血管ともに生体内での中枢から末梢へのネットワーク形成が早いなどの利点があり,有用なモデルとして数多くの研究が報告されている.ゼブラフィッシュの神経軸索は,体幹では背側の神経管内の細胞体から神経管外に腹側に伸ばすことでネットワークを形成する一方16),血管は体幹では腹側に背側大動脈を,さらに腹側には後主静脈を形成して,これらから分岐した血管により血管網を形成する.このとき,大動脈から背側に向かってVEGF-Aの濃度勾配に従って血管が伸長することで節間血管を形成することをきっかけに,血管網の形成が始まる17).
最近の研究では,運動神経特異的プロモーターMnx1依存的に緑色蛍光タンパク質を発現し,なおかつ血管内皮細胞特異的に赤色蛍光タンパク質を発現する個体を用いて,神経・血管を同時に観察することで,運動神経がいかなる大動脈からの誘導因子によって並走するかが解析されている18).この運動神経は,神経管から管外に出た軸索がまず腹側に向かって伸長し,大動脈を越えたところで頭側と尾側の両側に向かって伸びることが確認され,この際に大動脈とリンパ管の間を頭尾方向に軸索を伸ばすことが見いだされている.さらには,VEGFR3(VEGF受容体の一つ)の変異体を用いて,背側大動脈の腹側の神経軸索の走行を調べたところ,野生型で観察されているものがVEGFR3変異体では消失することが明らかとなっている.したがって,VEGFR3がこの領域における神経と血管の伴走に必要不可欠であることが示唆される.また,運動神経特異的にVEGFR3をFcで融合させたキメラタンパク質を発現させることで,大動脈からのVEGF-Cをトラップさせると,大動脈腹側の運動神経が消失することから,伴走には大動脈からのVEGF-Cが必要であることが明らかになっている.つまり,運動神経の一部がVEGF-C–VEGFR3シグナル依存的に血管と伴走することが示唆される.今後,両者が同時に支配する組織・臓器の調節機構が明確化されることが期待される.
6. 感覚神経は,動脈血管の分岐パターンを規定する
上述のように血管が神経の分化を調節するばかりではなく,神経が血管の分化を調節することもある.
マウス胎仔皮膚の血管網発生では,階層的な成熟血管網が構築される同時期に,末梢神経繊維が軸索を伸長し,神経回路を形成することが知られている.たとえば,動脈血管は,末梢感覚神経束(神経繊維およびそれを包む非ミエリンシュワン細胞)に接着することなく一定間隔で伴走し,血管分岐パターンを形成する19).このとき,感覚神経繊維も非ミエリンシュワン細胞もまったく存在しない表現型を示すNeurogenin1/Neurogenin2ダブルノックアウトマウスでは,皮膚血管網の階層性が崩れ,乱れた血管分岐パターンを示す20).この結果は,神経と血管の伴走を支配する共通のガイダンス因子は存在しないことを意味する.ガイダンス因子とは,誘引性および反発性として作用する分子群であり,ネトリンファミリー,エフリンファミリー,セマフォリンファミリー,スリットファミリー,およびVEGFファミリー,BMPファミリー,Wntファミリー,ケモカインなどの分泌性タンパク質を含み,これらは神経系と血管系のパターニングを調節する共通分子として注目されている21).しかしながら,これらの軸索ガイダンス因子は,発芽的な血管新生を制御するが,階層性のある成熟血管網や神経–血管ワイヤリングの構築には寄与しないと考えられている.
一方で,皮膚の感覚神経網が無秩序に構築されるSema3Aノックアウトマウスの胎仔皮膚では,乱れた感覚神経繊維分岐パターンに沿って動脈血管が並走することが報告されており22),また,発生のタイミングも感覚神経束の分岐パターンが形成された後に動脈血管分岐パターンが形成されることが見いだされている.つまり,マウス胎仔皮膚においては,感覚神経束分岐がくさび形となって,動脈血管分岐パターンが規定されると考えられる(図2b).これを制御するシグナルとして,非ミエリンシュワン細胞ではケモカインCXCL12を顕著に発現する一方で,原始血管叢の一部の血管内皮細胞ではCXCR4を特異的に発現することから,CXCL12–CXCR4シグナルが感覚神経由来のくさび形として,動脈血管分岐パターンを制御すると考えられる23).
また,マウス胎仔の感覚神経繊維および非ミエリンシュワン細胞由来の分泌タンパク質の中から血管内皮細胞の動脈化を促進する分子が探索され,VEGF-Aが同定されている21, 23).実際,VEGFR2(VEGF-A受容体)の共受容体であるNeuropilin 1の血管内皮特異的ノックアウトマウスでは,同様に動脈化が阻害されることが確認されている23).以上のように,神経と血管の相互依存性は,神経が血管ネットワークを規定することもあれば,血管が神経ネットワークを規定することもあり,いずれにしても,両者が綿密な関連性を持って,神経と血管のワイヤリングが構築される.
上述のとおり,発生過程で神経系と血管系の伴走を制御する分子機構の知見が蓄積しつつあるが,神経幹細胞の挙動と血管発生については,未解明の問題を数多く残している.一方,骨髄における微小環境としての血管の役割は重要な知見が数多く見いだされており,これらの情報は神経幹細胞における血管の役割を考える上で重要なヒントを与えている.
組織幹細胞は,他の細胞や細胞外マトリックスから構成される特殊な微小環境である幹細胞ニッチとの相互作用を通じ,その性質を維持する.硬組織である骨の内部に形成される骨髄は,外界からの刺激を適度に遮断する好適な環境であり,組織幹細胞の良好なニッチを提供する.骨髄は,造血系幹細胞と間葉系幹細胞の2種類の幹細胞が共存し,これら2種類の幹細胞はともに骨髄の微小血管の周囲に存在し,幹細胞どうしが互いに近接し複雑に相互作用しながら,幹細胞を維持する分子機構が働いている.
大部分の骨は,内軟骨性骨化により形成される.この過程においてはじめに形成される軟骨原基は無血管組織であるが,やがて原基が増大し中心部の軟骨細胞が肥大化すると,VEGFをはじめとするパラクライン因子を産生する.その結果,原基をとりまく周軟骨膜から原基内部への血管の進入と増殖が促される.この血管新生に伴い,転写因子Osxを発現する周軟骨膜の骨芽前駆細胞が原基内部へ移動することが示されており24),続いて骨芽細胞および間質細胞へと分化し,一次骨化中心を形成する.その後,マウスでは胎齢16日前後に,造血系幹細胞が胎生肝臓から骨の内部へ遊走して活発に増殖することで,骨髄造血を確立する.このような骨髄造血の確立は,骨髄内部における特徴的な血管網の確立と密接に関連していることが知られている.
骨髄には洞様毛細血管という特殊な静脈のネットワークが存在し,血液細胞の一部はこの血管内皮細胞と接触していることから,古くから造血にとって重要な細胞であることが推測されていた.2005年にMorrisonらはCD150+CD48−CD41−細胞の多くが洞様毛細血管に接触することから,血管内皮細胞がニッチを構成すると報告し,血管ニッチという概念を提唱した25).さらには,造血幹細胞の維持に必須のサイトカインであるSCFおよびCXCL12を血管内皮細胞特異的に欠損させたマウスでは,造血幹細胞が減少することを示し,血管内皮細胞が造血幹細胞ニッチとして必須の役割を果たすことを報告している26, 27).
体内の酸素分圧は臓器や組織ごとに多彩であることが知られている.その中でも骨髄は,骨を貫いて進入する血管の数が限られているために酸素の供給が限定された低灌流な臓器とされる.加えて,骨髄を満たす血球細胞が活発に酸素を消費するために,結果として低酸素環境となる.このため,骨髄では低酸素環境が重要な微小環境を構築することが指摘されており,骨髄の酸素供給と酸素消費に基づいたシミュレーションからも,骨髄は組織全体が低酸素環境であることが示唆されている28).実際に,マウスやヒトの造血幹細胞は,組織学的な解析によって低酸素応答性のpimonidazoleを保持することが報告されている29, 30).さらには,低酸素プローブを用いた直接的な解析から,骨髄はたとえ血管近傍であっても低酸素分圧であることが報告されている31).低酸素誘導因子(hypoxia inducible factor:HIF)-1αは,通常の大気中の酸素分圧では酸素依存性のプロリン水酸化酵素PHDによってユビキチン・プロテアソーム系によって分解されるが,骨髄の細動脈近傍や洞様血管近傍ではHIF-1αタンパク質が安定化するのに十分な低酸素環境であり,実際に,ほとんどすべての造血幹細胞がHIF-1αタンパク質を安定化している.また,間葉系前駆細胞のうち,細動脈近傍の細胞は未分化性が高いという報告もあることから32),HIF-1αタンパク質を発現する造血幹細胞は,酸素分圧が若干高い細動脈近傍から,酸素分圧が若干低い洞様血管近傍へと移行しながら増殖期に入ると考えられている.
以上のように,造血臓器である骨髄には組織幹細胞を維持する特殊な微小環境が存在しており,同様に,各々の組織・臓器に適した微小環境がそれぞれの幹細胞の維持と分化の調節に密接に関与することが示唆される.
最後に,マウスの大脳皮質の発生をモデルとして,神経幹細胞の調節因子としての血管の役割について述べたい.
大脳皮質発生過程の神経幹細胞は,増殖と分化の均衡を保ちながら自らの性質を刻々と変化することで,異なるサブタイプの大脳皮質ニューロンを規則的に産み出し,その結果,整然とした皮質階層構造を構築している.このためには,発生期大脳皮質の神経幹細胞が未分化性の維持と分化の均衡を精巧に調節する必要があり,中でも,Wnt-βカテニンシグナルやDelta-Notchシグナルが重要な役割を果たす33–36).我々のこれまでの研究から(未発表データを含む),比較的均一な集団と考えられている神経幹細胞の中でも未分化性の特に高いNotchhigh幹細胞は37),低酸素に応答する複数の遺伝子群の発現が顕著に高く,実際,微小酸素センサーを用いた定量実験から,発生期の大脳皮質の脳室帯近傍は組織酸素濃度が低いことが見いだされている(投稿中).また,HIF-1αは,Notchタンパク質の安定化38)やβカテニンの活性化39)に寄与することが報告されているのに加えて,最近の研究では,HIF-1αの量的な変化が幹細胞の維持から分化への移行に寄与することが明らかになっている40).さらには,低酸素環境に置かれた神経幹細胞はミトコンドリアに局在する活性酸素種量が多い集団として観察されるが,細胞周期を離れて分化状態が進行するにつれて活性酸素種量が徐々に減少し,これが正常な神経分化に決定的な役割を果たすことが,我々の最近の研究によって確認されている41).
こうした組織内の低酸素環境は,発生期の規則的な血管の配置と密接に関連していることから(投稿中),骨髄のように組織全体がそもそも低酸素である環境とは異なり,発生期の大脳皮質においてはきわめて限定的な領域が低酸素環境に置かれていることが見いだされている(投稿中).つまり,発生過程において規則的に血管を構築していく過程こそが,幹細胞の微小環境の構築と密接な関連性にあると考えられる.近年,血管内皮細胞由来の液性因子が神経幹細胞の増殖と維持に寄与すること42),Tbr2陽性の分裂期にある中間型前駆細胞は血管分岐点に位置すること43),オリゴデンドロサイト前駆細胞は血管を足場として移動した後に血管から離れることで分化に向かうこと44)などが報告されているが,組織内に形成される血管の発生機序についてはほとんど明確化されていなかった.
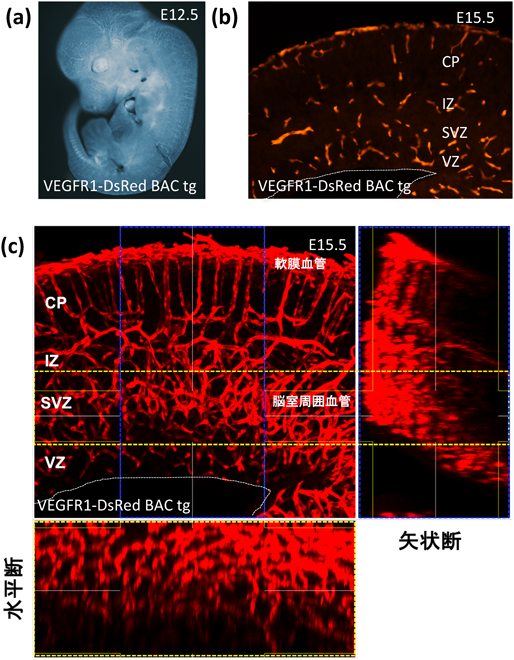
解剖学的には,大脳皮質を構築する血管は,軟膜を覆う軟膜血管と,大脳皮質実質に形成される脳室周囲血管に区別される(図3).最近の研究では,前者は胎齢10日にはおおむね発生が完了しているが,後者は神経組織の肥厚と協調して発生が進行し,内皮細胞と神経堤由来の周皮細胞が別々に終脳基底核近傍から胎齢10日ごろに進入し,腹側から背側へとダイナミックに血管網を構築することが報告されている45).このとき,適切に(密度,方向性,形態,低酸素領域など)血管網を作ることが大脳皮質の組織構築に必要不可欠なため,きわめて規則的に血管発生が進行するが(図3),この複雑な三次元パターンを有する血管が,いかに自律的に,かつ精確に作られるかは,未解明の問題として残されている.我々は,大脳皮質の血管密度が変化すると,神経幹細胞の維持と分化の均衡が破綻することを見いだしており(投稿中),組織内における規則的な血管発生は神経幹細胞の維持と分化を制御する細胞外環境として,きわめて重要な働きをしている可能性がある.さらには,終脳腹側に位置する血管内皮細胞は腹側の神経幹細胞が発現する転写因子Dlx2を発現するが,この内皮細胞が腹側から背側へと進入する際に,背側の神経幹細胞が発現する転写因子Pax6を発現するように変化することが報告されており45),また,血管内皮細胞は抑制性ニューロンが腹側から背側へと移動する際に重要なガイド役を担うことが明らかとなっている46).すなわち,内皮細胞は不均一な細胞集団であり,血管が持つ位置・時間情報が,神経系との協調的な発生・分化に重要な役割を果たす可能性が示唆される.
発生期大脳皮質における血管は,単に成長する神経集団からの酸素や栄養の要求に応答するために受動的に発生するのではなく,時間特性・領域特性を付与された内皮細胞が決まった場所に,決まったタイミングで規則的に発生し,これが神経幹細胞の維持や分化の均衡を調節する細胞外環境としてきわめて重要な役割を果たしている可能性がある.今後,正常発生における神経と血管のワイヤリングの詳細を追求することで,これが破綻することで生じる疾患や,中枢神経系の分化誘導技術の確立に応用可能な知見を見いだしていきたい.
また,組織・臓器に構築される血管網のパターニングはそれぞれ大きく異なるため,各々の組織・臓器の血管を丹念に観察することで血管の構築機構の共通点と相違点を明確化することは,中枢神経系に限らず,さまざまな組織・臓器の発生・再生現象の解明に大きく貢献することが期待される.
引用文献References
1) Lo, E.H., Dalkara, T., & Moskowitz, M.A. (2003) Nat. Rev. Neurosci., 4, 399–415.
2) Yamori, Y., Horie, R., Handa, H., Sato, M., & Fukase, M. (1976) Stroke, 7, 46–53.
3) Mizutani, K., Ikeda, K., Kawai, Y., & Yamori, Y. (1999) J. Hypertens., 17, 481–487.
4) Wurmser, A.E., Palmer, T.D., & Gage, F.H. (2004) Science, 304, 1253–1255.
5) Moskowitz, M.A., Lo, E.H., & Iadecola, C. (2010) Neuron, 67, 181–198.
6) Zlokovic, B.V. (2010) Nat. Med., 16, 1370–1371.
7) Iadecola, C. (2004) Nat. Rev. Neurosci., 5, 347–360.
8) Ishitobi, H., Matsumoto, K., Azami, T., Itoh, F., Itoh, S., Takahashi, S., & Ema, M. (2010) Exp. Anim., 59, 615–622.
9) Matsumoto, K., Azami, T., Otsu, A., Takase, H., Ishitobi, H., Tanaka, J., Miwa, Y., Takahashi, S., & Ema, M. (2012) Genesis, 50, 561–571.
10) Vesalius, A. (1544) De Human Corpories Fabrica. Book II, p. 268. Translted by Richardson, W.F. (1999) On the Fabric of the Human Body. Book II, p. 234. As quoted by Byum, W.F., Porter, R. (2005) Oxford Dictionary of Science Quotations. 595: 2, Oxford University Press.
11) Carmeliet, P. & Tessier-Lavigne, M. (2005) Nature, 436, 193–200.
12) Gerhardt, H., Golding, M., Fruttiger, M., Ruhrberg, C., Lundkvist, A., Abramsson, A., Jeltsch, M., Mitchell, C., Alitalo, K., Shima, D., & Betsholtz, C. (2003) J. Cell Biol., 161, 1163–1177.
13) Hellström, M., Phng, L.K., Hofmann, J.J., Wallgard, E., Coultas, L., Lindblom, P., Alva, J., Nilsson, A.K., Karlsson, L., Gaiano, N., Yoon, K., Rossant, J., Iruela-Arispe, M.L., Kalén, M., Gerhardt, H., & Betsholtz, C. (2007) Nature, 445, 776–780.
14) Reissmann, E., Ernsberger, U., Francis-West, P.H., Rueger, D., Brickell, P.M., & Rohrer, H. (1996) Development, 122, 2079–2088.
15) Saito, D., Takase, Y., Murai, H., & Takahashi, Y. (2012) Science, 336, 1578–1581.
16) Menelaou, E. & McLean, D.L. (2012) J. Neurosci., 32, 10925–10939.
17) Isogai, S., Lawson, N.D., Torrealday, S., Horiguchi, M., & Weinstein, B.M. (2003) Development, 130, 5281–5290.
18) Kwon, H.B., Fukuhara, S., Asakawa, K., Ando, K., Kashiwada, T., Kawakami, K., Hibi, M., Kwon, Y.G., Kim, K.W., Alitalo, K., & Mochizuki, N. (2013) Development, 140, 4081–4090.
19) James, J.M. & Mukouyama, Y.S. (2011) Semin. Cell Dev. Biol., 22, 1019–1027.
20) Mukouyama, Y.S., Shin, D., Britsch, S., Taniguchi, M., & Anderson, D.J. (2002) Cell, 109, 693–705.
21) Melani, M. & Weinstein, B.M. (2010) Annu. Rev. Cell Dev. Biol., 26, 639–665.
22) Li, W., Kohara, H., Uchida, Y., James, J.M., Soneji, K., Cronshaw, D.G., Zou, Y.R., Nagasawa, T., & Mukouyama, Y.S. (2013) Dev. Cell, 24, 359–371.
23) Mukouyama, Y.S., Gerber, H.P., Ferrara, N., Gu, C., & Anderson, D.J. (2005) Development, 132, 941–952.
24) Maes, C., Kobayashi, T., Selig, M.K., Torrekens, S., Roth, S.I., Mackem, S., Carmeliet, G., & Kronenberg, H.M. (2010) Dev. Cell, 19, 329–344.
25) Kiel, M.J., Yilmaz, O.H., Iwashita, T., Yilmaz, O.H., Terhorst, C., & Morrison, S.J. (2005) Cell, 121, 1109–1121.
26) Ding, L., Saunders, T.L., Enikolopov, G., & Morrison, S.J. (2012) Nature, 481, 457–462.
27) Ding, L. & Morrison, S.J. (2013) Nature, 495, 231–235.
28) Chow, D.C., Wenning, L.A., Miller, W.M., & Papoutsakis, E.T. (2001) Biophys. J., 81, 685–696.
29) Nombela-Arrieta, C., Pivarnik, G., Winkel, B., Canty, K.J., Harley, B., Mahoney, J.E., Park, S.Y., Lu, J., Protopopov, A., & Silberstein, L.E. (2013) Nat. Cell Biol., 15, 533–543.
30) Takubo, K., Goda, N., Yamada, W., Iriuchishima, H., Ikeda, E., Kubota, Y., Shima, H., Johnson, R.S., Hirao, A., Suematsu, M., & Suda, T. (2010) Cell Stem Cell, 7, 391–402.
31) Spencer, J.A., Ferraro, F., Roussakis, E., Klein, A., Wu, J., Runnels, J.M., Zaher, W., Mortensen, L.J., Alt, C., Turcotte, R., Yusuf, R., Côté, D., Vinogradov, S.A., Scadden, D.T., & Lin, C.P. (2014) Nature, 508, 269–273.
32) Kunisaki, Y., Bruns, I., Scheiermann, C., Ahmed, J., Pinho, S., Zhang, D., Mizoguchi, T., Wei, Q., Lucas, D., Ito, K., Mar, J.C., Bergman, A., & Frenette, P.S. (2013) Nature, 502, 637–643.
33) Hirabayashi, Y., Itoh, Y., Tabata, H., Nakajima, K., Akiyama, T., Masuyama, N., & Gotoh, Y. (2004) Development, 131, 2791–2801.
34) Pierfelice, T., Alberi, L., & Gaiano, N. (2011) Neuron, 69, 840–855.
35) Mizutani, K. & Saito, T. (2005) Development, 132, 1295–1304.
36) Kawaguchi, D., Yoshimatsu, T., Hozumi, K., & Gotoh, Y. (2008) Development, 135, 3849–3858.
37) Mizutani, K., Yoon, K., Dang, L., Tokunaga, A., & Gaiano, N. (2007) Nature, 449, 351–355.
38) Gustafsson, M.V., Zheng, X., Pereira, T., Gradin, K., Jin, S., Lundkvist, J., Ruas, J.L., Poellinger, L., Lendahl, U., & Bondesson, M. (2005) Dev. Cell, 9, 617–628.
39) Mazumdar, J., O’Brien, W.T., Johnson, R.S., LaManna, J.C., Chavez, J.C., Klein, P.S., & Simon, M.C. (2010) Nat. Cell Biol., 12, 1007–1013.
40) Lange, C., Turrero, G.M., Decimo, I., Bifari, F., Eelen, G., Quaegebeur, A., Boon, R., Zhao, H., Boeckx, B., Chang, J., Wu, C., Le, N.F., Lambrechts, D., Dewerchin, M., Kuo, C.J., Huttner, W.B., & Carmeliet, P. (2016) EMBO J., 35, 924–941.
41) Inoue, M., Iwai, R., Tabata, H., Konno, D., Suzuki-Komabayashi, M., Watanabe, C., Iwanari, H., Mochizuki, Y., Hamakubo, T., Matsuzaki, F., Nagata, K., & Mizutani, K. (2017) Development, 144, 385–399.
42) Shen, Q., Goderie, S.K., Jin, L., Karanth, N., Sun, Y., Abramova, N., Vincent, P., Pumiglia, K., & Temple, S. (2004) Science, 304, 1338–1340.
43) Javaherian, A. & Kriegstein, A. (2009) Cereb. Cortex, 19(Suppl 1), i70–i77.
44) Tsai, H.H., Niu, J., Munji, R., Davalos, D., Chang, J., Zhang, H., Tien, A.C., Kuo, C.J., Chan, J.R., Daneman, R., & Fancy, S.P. (2016) Science, 351, 379–384.
45) Vasudevan, A., Long, J.E., Crandall, J.E., Rubenstein, J.L., & Bhide, P.G. (2008) Nat. Neurosci., 11, 429–439.
46) Won, C., Lin, Z., Kumar, T.P., Li, S., Ding, L., Elkhal, A., Szabó, G., & Vasudevan, A. (2013) Nat. Commun., 4, 2149.
著者紹介Author Profile
 水谷 健一(みずたに けんいち)
水谷 健一(みずたに けんいち)神戸学院大学大学院薬学研究科幹細胞生物学研究室特命教授.博士(人間環境学).
略歴2002年京都大学人間・環境学研究科修了.同年京都大学再生医科学研究所研究員.05年ジョンズホプキンス大学研究員.10年JSTさきがけ研究者.12年同志社大学准教授PI.17年より現職.
研究テーマと抱負幹細胞の内在的な性質と細胞外環境の連携が,如何に組織の発生・再生に寄与するのかに着目し,研究を推進している.自分なりの基礎発生学を追求することで,組織幹細胞の能力を分子的に解明したい.
ウェブサイトhttp://accafe.jp/mizutani_lab/