近年,幹細胞を利用した再生医療樹立の試みが数多く実施されている.再生医療への応用が期待される幹細胞として,胚性幹細胞(embryonic stem cell:ES細胞)や人工多能性幹細胞(induced pluripotent stem cell:iPS細胞)などが知られているが,ES細胞の医療応用は倫理的な理由から制限され,また,iPS細胞の医療応用はその発がん性の理由から制限されている.一方,間葉系幹細胞(mesenchymal stem cell:MSC)などの体性幹細胞は,倫理的な問題点や発がん性などのリスクを避けて用いることのできる利便性を有しており,再生医療の現場での有用性の高い幹細胞である.
特に,MSCは骨髄や脂肪組織などに存在し,骨芽細胞,軟骨細胞ならびに脂肪細胞に分化する幹細胞である1).MSCは,プラスチック培養プレートに接着して増殖しコロニーを形成するとともに,CD73(ecto-5′-nucleotidase),CD90(Thy1)ならびにCD105(endoglin, SH2)などの細胞表面抗原を発現するが,CD34, CD45あるいはHLA-DRなどの造血性細胞表面抗原を発現しない2).最近では,CD146やCD271(low-affinity nerve growth factor receptor)もMSCに特異的に発現するものとして解釈されている1).MSCの分離は,骨髄組織あるいは脂肪組織由来細胞集団から,セルソーターを利用して,MSC特異的表面抗原を認識する抗体への結合を指標に行う.その後,プラスチック培養プレート表面に付着するMSCを培養し増殖させるが,その増殖に伴い,MSCの老化による増殖能の低下,あるいは多分化能の低下が生じてしまう3).このため,組織再生に十分な数のMSCをex vivoでの培養で獲得するにはMSCの増殖に伴う増殖能の低下や細胞死を防ぐとともに,この細胞の多分化能を維持する手法の開発が必要である.我々は,ヒトMSC細胞株が骨芽細胞分化する前後の遺伝子発現頻度差を網羅的に解析し,MSCのstemness(幹細胞性:細胞生存率や細胞移動能ならびに多分化能)の維持に働く新たな分子機構を発見した.
2. SCRG1とBST1による新たなリガンド/受容体系がMSCの幹細胞性に与える影響について
ヒトMSC細胞株UE7T-13を骨芽細胞誘導培地で刺激した前後でのmRNAを抽出しDNAマイクロアレイを用いて遺伝子発現を解析したところ,Scrapie responsive gene 1(SCRG1)遺伝子の発現が骨芽細胞分化後では分化前と比較して20分の1に減少していた4).SCRG1遺伝子はスクレイピーに感染して伝達性海綿状脳症(transmissible spongiform encephalopathy:TSE)を呈したマウスの脳でその発現が増加する遺伝子として報告された5).SCRG1はN末端に分泌シグナルを有する98個のアミノ酸からなるペプチドであるが,TSEでみられる神経細胞変性に伴いその発現が認められるとの報告があり,TSE発症との関連性が注目されている6).MSCにおけるSCRG1の機能は不明であったため,SCRG1がUE7T-13細胞のstemnessにどのように関わるかを検討した.
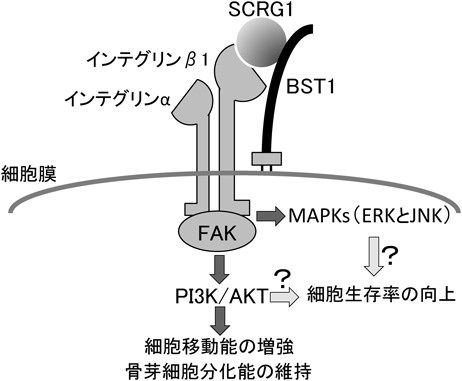
まず,ヒトSCRG1リコンビナントタンパク質(recombinant human SCRG1:rhSCRG1)を作製しUE7T-13細胞に投与したところ,MSCの細胞移動に深く関わるとされるextracellular signal-regulated kinase(ERK),c-jun N-terminal kinase(JNK),ならびにphosphoinositide 3-kinase(PI3K)/AKTの活性化が認められた.興味深いことに,rhSCRG1によるこれらのシグナル伝達分子の活性化は骨芽細胞分化誘導後のUE7T-13細胞では認められないため,SCRG1受容体の発現がこの細胞の骨芽細胞分化とともに減少するものと仮定し,次にSCRG1受容体の同定を試みた.先に述べたDNAマイクロアレイの結果を確かめたところ,膜結合タンパク質をコードする遺伝子であるbone marrow stromal cell antigen 1(BST1)とhyaluronan sysnthase 2(HAS2)の発現が,骨芽細胞分化に伴い減少していた.これらの膜結合タンパク質のうちBST1の遺伝子をノックダウンしたところUE7T-13細胞におけるrhSCRG1によるAKTやERKシグナルの活性化が抑制されたが,HAS2遺伝子のノックダウンでは抑制されなかった.加えて,BST1タンパク質が免疫沈降法によりrhSCRG1と共沈することが確認されたことから,BST1がSCRG1のMSCにおける受容体であることが強く示唆された.また,SCRG1/BST1からの刺激はUE7T-13細胞の移動能をfocal adhesion kinase(FAK)ならびにPI3K依存的に促進した.なお,BST1はインテグリンβ1あるいはβ2と複合体を形成しFAKを活性化することが知られている7)ことから,我々はSCRG1とBST1によるシグナル伝達様式が図1のように行われるものと予測している.さらには,骨髄由来MSC(bone marrow-derived MSC:BM-MSC)の初代培養細胞では,通常この細胞の移動能は継代数の増加(細胞増殖)に伴い減少するが,rhSCRG1刺激下で増殖させた場合には移動能は維持された.以上の結果より,SCRG1はMSC表面のBST1に結合し,細胞移動能をFAKならびにPI3K依存的に増強することが初めて示された4).
一方,UE7T-13細胞を骨芽細胞分化誘導培地で刺激した際,rhSCRG1は,この細胞の骨芽細胞分化をFAKならびにPI3K依存的に抑制した.また,rhSCRG1刺激下で増殖した初代培養BM-MSCでは,通常では継代数の増加(細胞増殖)に伴い低下する骨芽細胞分化能が維持された4).これらの結果から,rhSCRG1はMSCの未分化性を保ち,その骨芽細胞分化能を維持する働きがあると考えられた.さらに,rhSCRG1で刺激した初代培養BM-MSCでは,通常では継代数の増加(細胞増殖)に伴い低下する細胞生存率が維持されたままの状態となった4).特に最近,CD271+/CD90+/CD106high+のMSCは高い自己複製能と多分化能を有すると報告されている5).BM-MSCでのCD271の発現は通常では継代数の増加に伴い減少するが,rhSCRG1を与えた細胞ではその発現が維持された.さらに,幹細胞の多分化能を維持する転写因子POU5F1の発現は,通常ではBM-MSCの継代数の増加に伴い減少するが,rhSCRG1を与えた細胞ではその発現が維持された4).
SCRG1/BST1系による刺激はex vivoで増殖中のMSCの移動能,生存能,ならびに骨芽細胞分化能を保ち,この細胞のstemnessの維持に働くことが明らかになった.なお,SCRG1/BST1刺激による細胞生存率の上昇効果がどのようなシグナル伝達経路を介して働くのか,また,SCRG1を免疫沈降した際にBST1とともに共沈するインテグリンβ1がSCRG1/BST1系によるstemnessの維持機構にどのように関わるかについても解析が必要と考える.
3. MSCどうしの細胞接着がstemnessに与える影響について
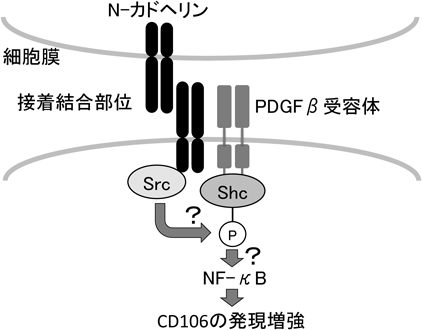
我々は以前に,UE7T-13細胞が細胞密度依存的にCD106の発現を上昇させることを報告した8).そこで,MSCどうしの接着結合(adherence junction:AJ)の主要な構成分子であるN-カドヘリン9)に注目し,この分子がUE7T-13細胞における細胞密度依存的なCD106の発現にどのように働くかを検討した.一方,Liuらは,血管内皮細胞どうしの接着におけるVE-カドヘリン間の結合により,その近隣に存在する受容体型チロシンキナーゼ(receptor tyrosine kinase:RTK)の一つである血管内皮細胞増殖因子(vascular endothelial cell growth factor:VEGF)受容体がSrc依存的に,かつリガンド(VEGF)非依存的に活性化され,その結果,Shcをリン酸化して活性化することを見いだした10).また,この活性化Shcは,アテローム形成に関わる炎症性シグナルをnuclear factor-kappa B(NF-κB)依存的に伝えることが明らかにされた.興味深いことに,我々が見いだしたUE7T-13細胞における細胞密度依存的なCD106の発現促進効果もSrcならびにNF-κB依存的であることから8),UE7T-13細胞どうしの接着におけるN-カドヘリン間の結合により,近隣のRTKがSrc依存的に活性化された後,ShcとNF-κB依存的にCD106の発現が促進されるものと予測している(図2).実際に,platelet growth factor(PDGF)受容体(PDGF receptor:PDGFR)の阻害剤やPDGFRβの発現ノックダウンによりこの細胞密度依存的なCD106の発現促進効果が解除されたため,この効果はPDGFRβを介するものと判断された11).また,PDGFRβによるこのCD106の発現促進効果はリガンド(PDGF-BB)非依存的であった.一方,N-カドヘリンをUE7T-13細胞に強発現させると,この細胞におけるSrcの活性化が増強されるとともにCD106の発現が増加した11).今後,MSCどうしがN-カドヘリンにより接着した際に活性化されるSrc, PDGFRβならびにNF-κBが,Shcとともにいかなるシグナルカスケードを形成するか明確にしたい.
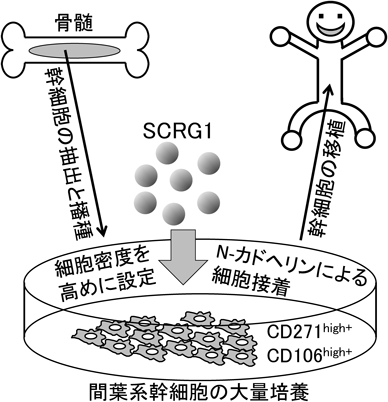
MSCのex vivoでの大量培養におけるstemnessの維持にはSCRG1/BST1系ならびにN-カドヘリンを介した細胞接着系によるCD271やCD106の発現誘導が関わることが示唆された.MSC培養系にSCRG1を投与するとともに細胞密度を高く保つことで,自己複製能と多分化能を併せ持つMSCが大量に調製できると期待される(図3).
最近我々は,蛍光タンパク質を全身の細胞で発現するトランスジェニックマウスから分離したMSCを株化することに成功した12, 13).テトラサイクリンなどの薬剤感受性発現ベクターにSCRG1を組み入れてこれを蛍光発現によりトレース可能なMSCに遺伝子導入した後にヌードマウスに移植して,SCRG1がin vivoでもMSCのstemnessの維持に働き,組織再生能を増強しうるか検討したい.また我々は,歯根膜線維芽細胞が細胞間接触によりMSCの骨芽細胞分化能を増強することを報告したが14),この効果にN-カドヘリンが関わるかどうか明らかにしたい.
最近,MSCは組織再生に働くだけでなく,慢性炎症を治癒させる免疫抑制効果があることが明らかにされた15).我々が見いだしたSCRG1/BST1やN-カドヘリン/PDGFRβを介した細胞内シグナルがMSCの免疫抑制効果の発現にどのように影響するかについても調べていきたい.
謝辞Acknowledgments
本稿で紹介した筆者らの研究成果は,岩手医科大学生化学講座細胞情報科学分野のスタッフをはじめ,ご指導,ご支援をいただきましたすべての先生方のお力添えによるものであり,この場をお借りして厚く御礼申し上げます.
引用文献References
1) Keating, A. (2012) Cell Stem Cell, 10, 709–716.
2) Dominici, M., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F., Krause, D., Deans, R., Keating, A., Prockop, D.J., & Horwitz, E. (2006) Cytotherapy, 8, 315–317.
3) Sensebé, L., Gadelorge, M., & Fleury-Cappellesso, S. (2013) Stem Cell Res. Ther., 4, 66.
4) Aomatsu, E., Takahashi, N., Sawada, S., Okubo, N., Hasegawa, T., Taira, M., Miura, H., Ishisaki, A., & Chosa, N. (2014) Sci. Rep., 4, 3652.
5) Mabuchi, Y., Morikawa, S., Harada, S., Niibe, K., Suzuki, S., Renault-Mihara, F., Houlihan, D.D., Akazawa, C., Okano, H., & Matsuzaki, Y. (2013) Stem Cell Rep., 1, 152–165.
6) Dron, M., Bailly, Y., Beringue, V., Haeberlé, A.M., Griffond, B., Risold, P.Y., Tovey, M.G., Laude, H., & Dandoy-Dron, F. (2005) Eur. J. Neurosci., 22, 133–146.
7) Lo Buono, N., Parrotta, R., Morone, S., Bovino, P., Nacci, G., Ortolan, E., Horenstein, A.L., Inzhutova, A., Ferrero, E., & Funaro, A. (2011) J. Biol. Chem., 286, 18681–18691.
8) Nishihira, S., Okubo, N., Takahashi, N., Ishisaki, A., Sugiyama, Y., & Chosa, N. (2011) Cell Biol. Int., 35, 475–481.
9) Wuchter, P., Boda-Heggemann, J., Straub, B.K., Grund, C., Kuhn, C., Krause, U., Seckinger, A., Peitsch, W.K., Spring, H., Ho, A.D., & Franke, W.W. (2007) Cell Tissue Res., 328, 499–514.
10) Liu, Y., Sweet, D.T., Irani-Tehrani, M., Maeda, N., & Tzima, E. (2008) J. Cell Biol., 182, 185–196.
11) Aomatsu, E., Chosa, N., Nishihira, S., Sugiyama, Y., Hiroyuki, M., & Ishisaki, A. (2014) Int. J. Mol. Med., 33, 565–572.
12) Sawada, S., Chosa, N., Takizawa, N., Yokota, J., Igarashi, Y., Tomoda, K., Kondo, H., Yaegashi, T., & Ishisaki, A. (2016) Mol. Med. Rep., 13, 2023–2031.
13) Furukawa, S., Kuwajima, Y., Chosa, N., Satoh, K., Ohtsuka, M., Miura, H., Kimura, M., Inoko, H., Ishisaki, A., Fujimura, A., & Miura, H. (2015) Exp. Ther. Med., 10, 1380–1386.
14) Suzuki, K., Chosa, N., Sawada, S., Takizawa, N., Yaegashi, T., & Ishisaki, A. (2017) Stem Cells Int., 2017, 3296498.
15) Regulski, M.J. (2017) Wounds, 29, 20–27.
著者紹介Author Profile
 石崎 明(いしさき あきら)
石崎 明(いしさき あきら)岩手医科大学生化学講座細胞情報科学分野教授.博士(歯学).
略歴1963年富山県に生る.88年東京医科歯科大学歯学部卒業.93年同大学院歯学研究科修了.ルートヴィック癌研究所などのポスドクを経験.2002年産業技術総合研究所主任研究員.03年岐阜大学医学部講師.05年北海道大学歯学部准教授.08年より現職.
研究テーマと抱負間葉系幹細胞の増殖・分化制御メカニズムに興味をもち,主に分子細胞生物学的な手法を用いて研究活動を進めている.今後は,歯根膜細胞等の口腔由来細胞や血球系細胞と間葉系幹細胞との相互作用における新たな発見を目指したい.
ウェブサイトhttp://cellbiosignal.jp/
趣味野球をすること観ること(現在,本学準硬式野球部顧問).手品やジャグリングなどのパフォーマンスをすること観ること(現在,本学パフォーマンス同好会顧問).
 帖佐 直幸(ちょうさ なおゆき)
帖佐 直幸(ちょうさ なおゆき)岩手医科大学生化学講座細胞情報科学分野講師.博士(地球環境科学).
略歴1972年鹿児島県奄美大島に生れる.95年岡山理科大学理学部卒業,2000年北海道大学大学院地球環境科学研究科博士課程単位取得満期退学,同年岩手医科大学歯学部助手,07年同助教,16年より現職.
研究テーマと抱負幹細胞の性状や機能を制御するシグナル伝達分子.特に生体内における体性幹細胞の多様な‘ふるまい’を解明していきたい.
ウェブサイトhttp://cellbiosignal.jp/
趣味お酒を呑みながらの家族団らん,時々運動.