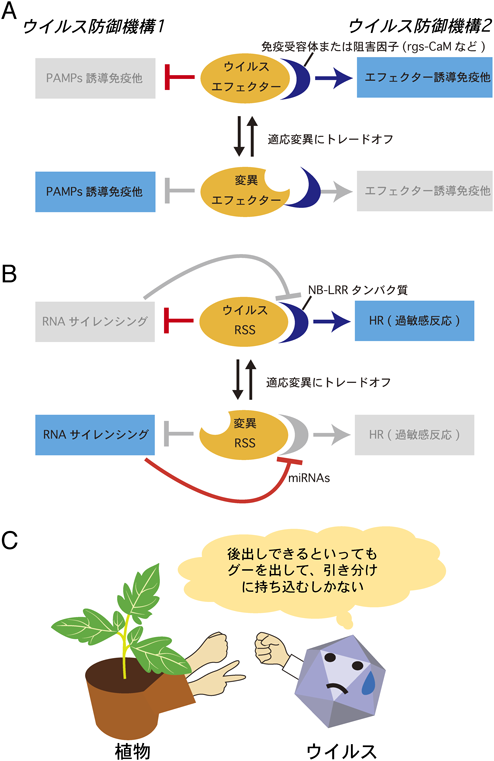
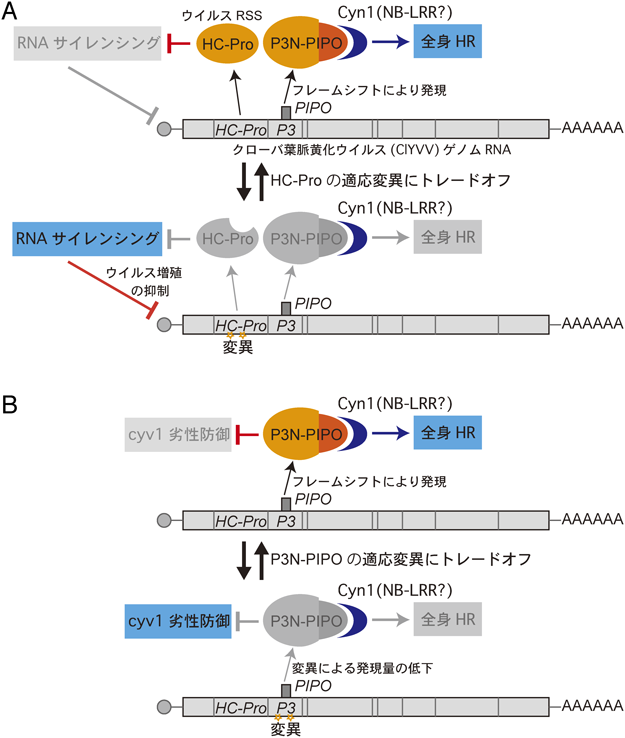
1) Choi, S.H., Hagiwara-Komoda, Y., Nakahara, K.S., Atsumi, G., Shimada, R., Hisa, Y., Naito, S., & Uyeda, I. (2013) J. Virol., 87, 7326–7337.
2) Atsumi, G., Suzuki, H., Miyashita, Y., Cho, S.H., Hisa, Y., Rihei, S., Shimada, R., Jeon, E.J., Abe, J., Nakahara, K.S., & Uyeda, I. (2016) J. Virol., 90, 7388–7404.
5) Niehl, A., Wyrsch, I., Boller, T., & Heinlein, M. (2016) New Phytol., 211, 1008–1019.
8) Shivaprasad, P.V., Chen, H.M., Patel, K., Bond, D.M., Santos, B.A., & Baulcombe, D.C. (2012) Plant Cell, 24, 859–874.
9) Zhai, J., Jeong, D.H., De Paoli, E., Park, S., Rosen, B.D., Li, Y., Gonzalez, A.J., Yan, Z., Kitto, S.L., Grusak, M.A., Jackson, S.A., Stacey, G., Cook, D.R., Green, P.J., Sherrier, D.J., & Meyers, B.C. (2011) Genes Dev., 25, 2540–2553.
10) Atsumi, G., Kagaya, U., Kitazawa, H., Nakahara, K.S., & Uyeda, I. (2009) Mol. Plant Microbe Interact., 22, 166–175.
11) Atsumi, G., Nakahara, K.S., Wada, T.S., Choi, S.H., Masuta, C., & Uyeda, I. (2012) Arch. Virol., 157, 1019–1028.
12) Ishibashi, K., Naito, S., Meshi, T., & Ishikawa, M. (2009) Proc. Natl. Acad. Sci. USA, 106, 8778–8783.
14) 中原健二,忠村一毅,Jeon, E. J. (2014)植物感染生理談話会論文集,49, pp. 59–68, 日本植物病理学会.
15) Nakahara, K.S., Masuta, C., Yamada, S., Shimura, H., Kashihara, Y., Wada, T.S., Meguro, A., Goto, K., Tadamura, K., Sueda, K., Sekiguchi, T., Shao, J., Itchoda, N., Matsumura, T., Igarashi, M., Ito, K., Carthew, R.W., & Uyeda, I. (2012) Proc. Natl. Acad. Sci. USA, 109, 10113–10118.