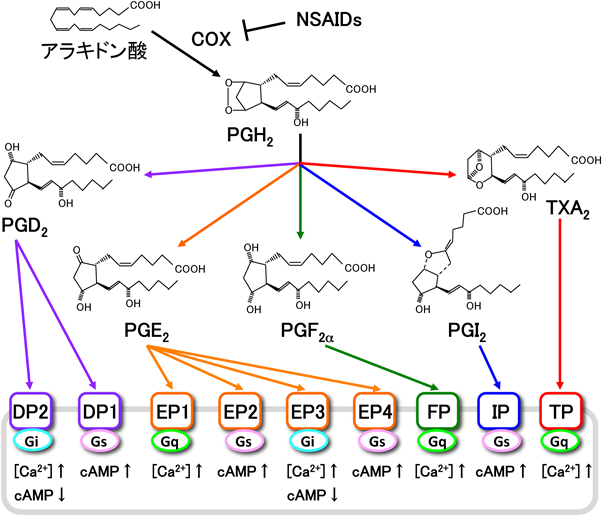
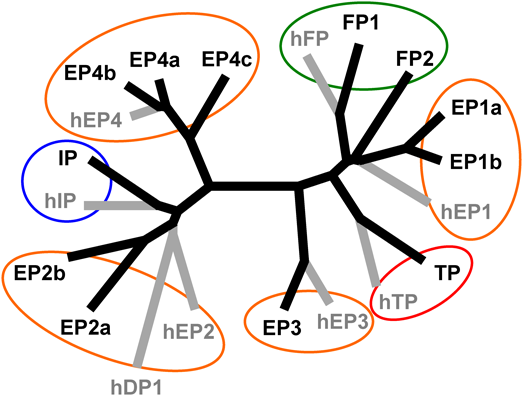
ゼブラフィッシュにおけるプロスタグランジンシステムProstaglandins in Zebrafish
熊本大学生命科学研究部薬学生化学分野Department of Pharmaceutical Biochemistry, Graduate School of Pharmaceutical Sciences, Kumamoto University ◇ 〒862–0973 熊本県熊本市中央区大江本町5番1号 ◇ 5–1 Oe-honmachi, Chuo-ku, Kumamoto 862–0973, Japan