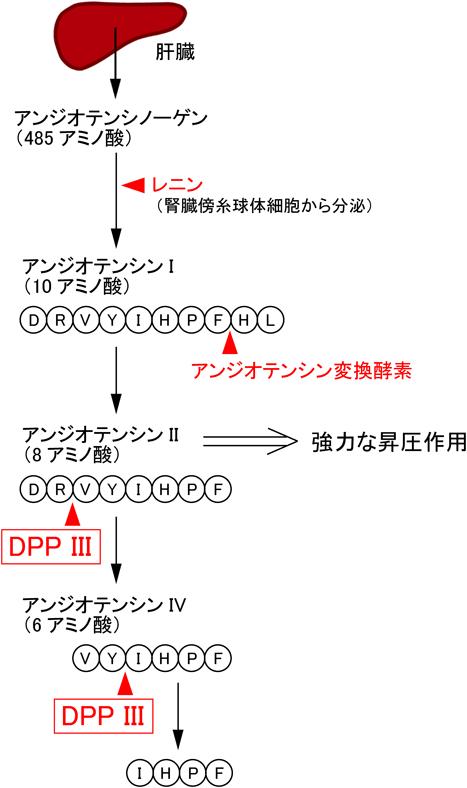
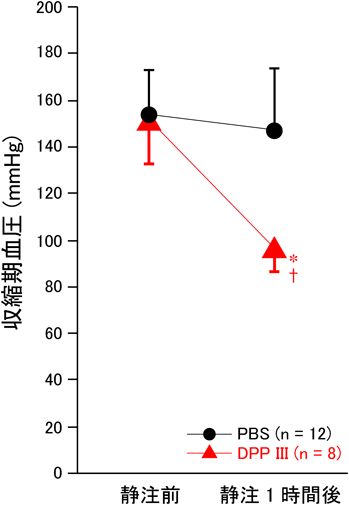
ジペプチジルペプチダーゼIIIのアンジオテンシンII分解活性と生体内での作用機序およびその治療応用への可能性Critical role of dipeptidyl peptidase III in cleavage of angiotensin II and its clinical implication
滋賀医科大学分子病態生化学Division of Molecular Medical Biochemistry, Department of Biochemistry and Molecular Biology, Shiga University of Medical Science ◇ 〒520–2192 滋賀県大津市瀬田月輪町 ◇ Seta Tsukinowa-cho, Otsu, Shiga 520–2192, Japan