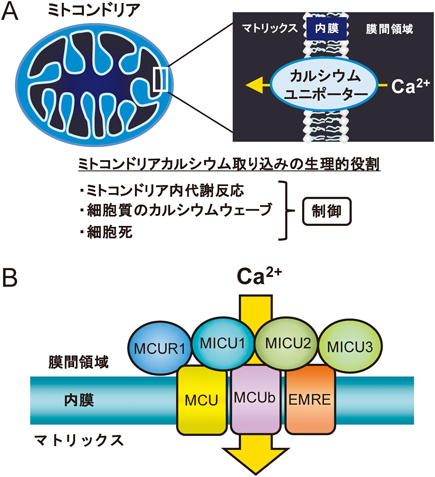
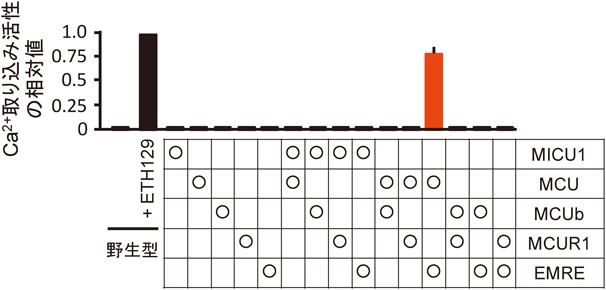
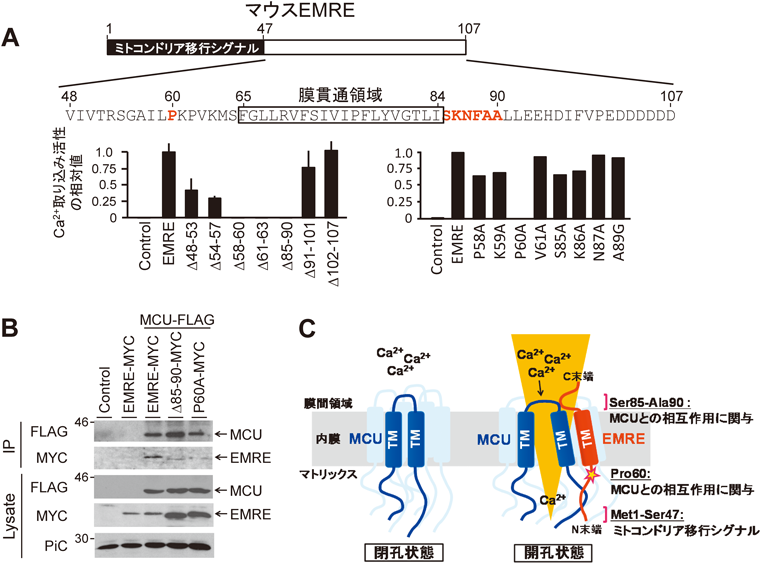
ミトコンドリアのCa2+取り込みに必須のタンパク質EMREの機能解析The Function of EMRE in Mitochondrial Calcium Uptake System
1 徳島大学先端酵素学研究所Institute of Advanced Medical Sciences ◇ 〒770–8503 徳島市蔵本町3–18–15 ◇ Kuramotocho-3, Tokushima 770–8503, Japan
2 徳島大学大学院医歯薬研究科Graduate School of Biomedical Sciences, Tokushima University ◇ 〒770–8503 徳島市蔵本町3–18–15 ◇ Kuramotocho-3, Tokushima 770–8503, Japan