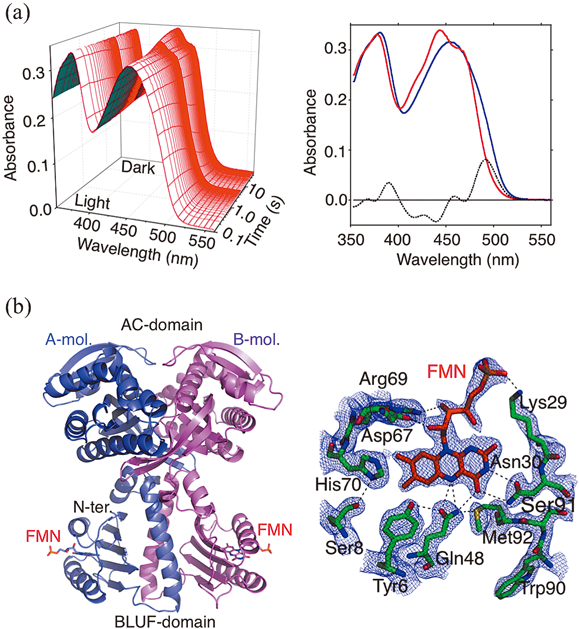
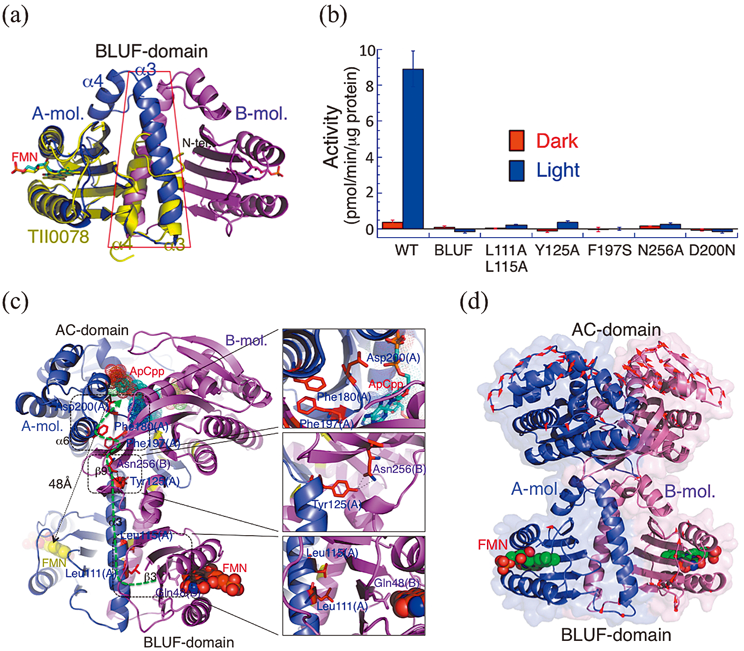
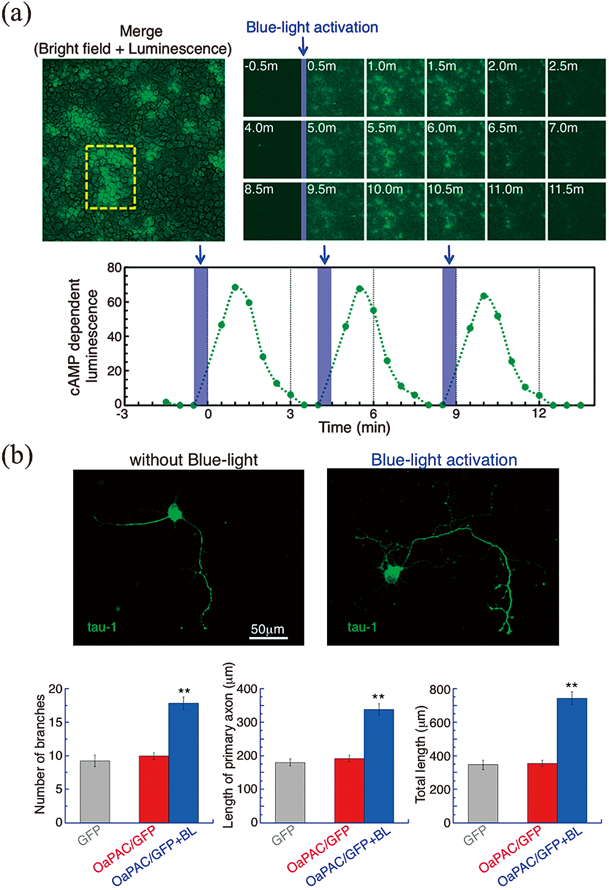
光活性化アデニル酸シクラーゼ合成酵素OaPACの活性化機構解明Structural and functional insights into a photoactivated adenylyl cyclase
1 横浜市立大学大学院・生命医科学研究科・構造創薬科学研究室Drug Design Laboratory, Graduate School of Medical Life Science, Yokohama City University ◇ 神奈川県横浜市鶴見区末広町1–7–29 ◇ 1–7–29 Suehiro, Tsurumi, Yokohama 230–0045, Japan
2 東邦大学薬学部・薬品物理分析学教室Faculty of Pharmaceutical Sciences, Toho University ◇ 千葉県船橋市三山2–2–1 ◇ Funabashi, Chiba 274–8510, Japan