近年,多くのがんは幹細胞の性質を持った「がん幹細胞」を起源に形成されるモデルが提唱されている.がん幹細胞は,非がん幹細胞と比較して幹細胞マーカーを高発現して自己複製能を兼ね備えており,高い腫瘍形成能を有すると考えられており,再発や転移に関与すると考えられる.したがって,がんを根治するためには,がん幹細胞の細胞生物学的な特性を理解して直接がん幹細胞を標的とする薬剤の開発が期待される.
筆者らは,がん幹細胞のマーカーであるアルデヒド脱水素酵素(ALDH)を用いて,がん幹細胞の増殖に関わる因子を探索し,脂質メディエーターの一種であるスフィンゴシン1-リン酸(S1P)が発生・分化に重要なNotchシグナルとの相互作用を介してさまざまながん幹細胞の増殖に関与することを明らかにした.そこで本稿では,がん幹細胞におけるS1P-Notchシグナルのクロストークを概説するとともに,がん幹細胞を標的とする創薬への展望と課題についても述べたい.
がん組織はさまざまな形態や特徴を持った不均一ながん細胞の集団であることは広く知られている.幹細胞の研究の進展によって,がん組織には未分化な細胞と分化した細胞が含まれており,正常組織と同様の階層性が存在することが明らかになってきた.正常組織の組織幹細胞と同様に,がん組織にもがんのもととなる幹細胞が存在し,自己複製とさまざまな特徴を持ったがん細胞への分化を繰り返すことで不均一ながんが形成されると考えられる1).がんが幹細胞の性質を持った少数の細胞集団を起源に形成されるというがん幹細胞のモデルは古くから提唱されてきたが,その実体は明らかになっていなかった.フローサイトメーターの技術が発展したこと,多くの正常組織において幹細胞が同定されたことなどにより,1997年に白血病においてがん幹細胞の存在が明らかにされた2).彼らは急性骨髄性白血病のCD34陽性CD38陰性の分画に腫瘍形成能の高い細胞集団が濃縮されていることを免疫不全マウスの移植実験により示した.さらに,造血幹細胞の研究結果が固形がんにおいても応用され,乳がん幹細胞の同定を契機に,脳,肺,前立腺など多くの組織からがん幹細胞が同定された.
がん幹細胞の同定・分離法は,前述の細胞表面抗原に加えて,スフィア形成法,SP(side population)細胞,細胞内のALDH活性を指標にする方法があげられる3).スフィア形成法は低接着ディッシュで形成される細胞塊(スフィア)が幹細胞の性質を有していることを指標にした方法で,臨床検体からがん幹細胞を濃縮するのに用いられることが多い.SP細胞はDNA染色剤であるHoechst33342の排出能が高い細胞として造血幹細胞の単離に使用されてきたが,SP細胞が幹細胞の性質を有することからがん幹細胞にも応用された.ALDHは細胞内のアルデヒドを酸化し解毒する酵素で,造血幹細胞でALDHの活性が高いことから正常幹細胞の同定・分離において用いられてきたが,その後乳がん幹細胞においても正常幹細胞と同様にALDH活性を指標に同定・分離できることが報告され,がんの種類に関わらず広く利用されることとなった4).臨床検体や細胞株から得られたALDH陽性細胞は,Oct3/4やNanog, c-Myc等の幹細胞マーカーの発現が高く,ドキソルビシンなどの抗がん剤に対して高い薬剤抵抗性を示し,ヌードマウスにおいて高い腫瘍形成能を有する.
乳がんは遺伝子発現のプロファイルによって五つのサブタイプに大別され,予後や治療薬が異なることが知られている.がん幹細胞とサブタイプの関連は,エストロゲン受容体陽性のLuminal型と比較して,エストロゲン,プロゲステロン,HER2受容体が陰性のトリプルネガティブ型の乳がんではALDH陽性細胞の割合が高く,ALDHの発現と乳がん患者の予後が逆相関することが報告されている5).また,悪性度の高い乳がんでは幹細胞関連遺伝子の発現が高く,乳がん患者の予後と幹細胞関連遺伝子の発現は逆相関するため,乳がん幹細胞の割合は予後の予測にも重要である6).
このように,臨床検体や細胞株から乳がん幹細胞の単離・同定が可能となり,シグナル伝達経路の解析をもとに乳がん幹細胞の特性が明らかになってきている.
正常な組織幹細胞は周囲の環境によって未分化状態が維持されていることから,がん幹細胞もオートクラインあるいは微小環境から放出されるパラクラインの因子によって幹細胞性の性質が維持されると考えられており,これまで多くの因子が報告されている.たとえば,乳がん細胞集団がエストロゲンで刺激されると,FGF9が放出されて乳がん幹細胞の生存が維持されることが報告されている.また,HER3/ErbB3に結合する増殖因子heregulinは,周囲の環境から放出されて乳がん幹細胞に作用しPI3キナーゼ/Akt/NF-κBを介して増殖を誘導する因子であると考えられる.PI3キナーゼ/AKT経路はSP細胞において亢進していることから,がん幹細胞の未分化維持シグナルとして興味深い.
筆者らも乳がん幹細胞の制御に関与する液性因子を明らかにするために,ヒト乳がん細胞株MCF-7にALDH陽性細胞が含まれることに着目し7),ALDH陽性細胞とALDH陰性細胞の遺伝子発現を網羅的に解析し,乳がん幹細胞に選択的に発現している受容体の探索を行った.その結果,従来知られているIL-8受容体,CXCR4ケモカイン受容体,EGF受容体などに加えて,新たに脂質メディエーターの一つであるS1Pに対する受容体が乳がん幹細胞に高発現していることを見いだし,S1Pによるがん幹細胞の制御機構が示唆された8).
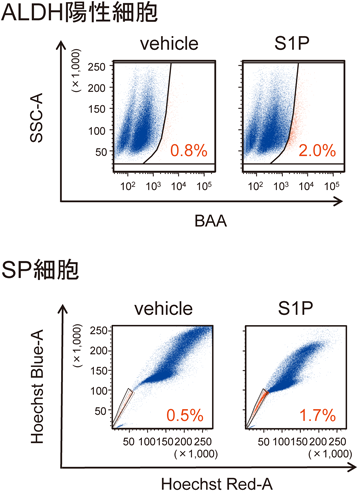
S1Pはスフィンゴ脂質由来の脂質メディエーターで,リゾホスファチジン酸(LPA)とともに血漿中に豊富に存在するリゾリン脂質である9).S1PはS1PR1~S1PR5の5種類のS1P受容体を介して,細胞の増殖や分化,遊走,炎症,神経機能など多彩な生理作用を示す.筆者らは,100 nM(血中に存在しうる生理的な濃度)のS1PでMCF-7細胞を刺激すると,ALDH陽性細胞の選択的な増加が認められることを見いだした.他のがん幹細胞の指標であるSP細胞も同様の増加がみられた(図1).また,S1PR3受容体アンタゴニストTY52156やS1PR3受容体のノックダウンによりS1P刺激による増殖作用が抑制されたことから,受容体のサブタイプはS1PR3であることが示唆された.さらに,S1PR3受容体アンタゴニストの持続投与は,ALDH陽性細胞の移植による腫瘍形成を顕著に抑制した.これらの結果は,S1PR3を介したがん幹細胞の増殖制御を示唆するものである.今後,脂質を標的としたがん幹細胞に対する新たな薬剤の開発が期待される.
また,S1PはMCF-7細胞に加えてBasal型のMDA-MB-231乳がん細胞株を増殖させたことから,乳がんのサブタイプに関わらず乳がん幹細胞に対して増殖作用を有すると考えられた.これにより,今までの乳がんの分類をがん幹細胞の観点から新たに見直す必要があるかもしれない.さらに興味深いことに,A549肺がん細胞,U251グリオーマ細胞,LNCaP前立腺がん細胞などにおいても同様にS1Pによるがん幹細胞の増殖作用を観察しており,S1Pは幅広いがん組織においてがん幹細胞の増殖作用を有することが示唆された.
さらに最近,卵巣がん幹細胞におけるLPAの新たな機能が報告された10).我々はBasal型の乳がん幹細胞においてもLPAによるがん幹細胞の増殖機構を確認しており(投稿中),がんの組織に関わらずがん幹細胞においてS1PやLPAをはじめとしたリゾリン脂質が広く機能していることが示唆される.これまでがん幹細胞において脂質の情報は少なく,我々はさまざまながん幹細胞を用いてリゾリン脂質を含めた網羅的な脂質解析を行い,脂質プロファイルの解明に取り組んでいる.今後,詳細なプロファイルを明らかにすることにより,新たな脂質の機能解明や標的分子の同定の進展が期待される.
では,どのようにS1P刺激により乳がん幹細胞の増殖が誘導されるのだろうか? 我々は幹細胞の自己複製に重要なNotch, Hedgehog, Wntシグナルに着目して,それぞれの標的遺伝子の活性化を検討した.その結果,S1PによってNotchの標的遺伝子であるHes1の活性化のみが誘導されることを見いだし,S1PとNotchのクロストークが示唆された.S1Pによる乳がん幹細胞の増殖作用はNotch選択的阻害剤DAPTにより抑制されたこと,Notchの細胞内領域であるNICD(Notch intracellular domain)の過剰発現によりがん幹細胞の増殖が認められたことから,NotchはS1Pの主要な幹細胞シグナルであると考えられた.これまでS1Pはがん幹細胞以外にも,造血幹細胞やES細胞の分化など幹細胞における機能的役割が報告されている11).これらの現象に対して幹細胞シグナルはあまり解析されてこなかったが,Notchなどの幹細胞シグナルにより説明できる可能性が考えられる.
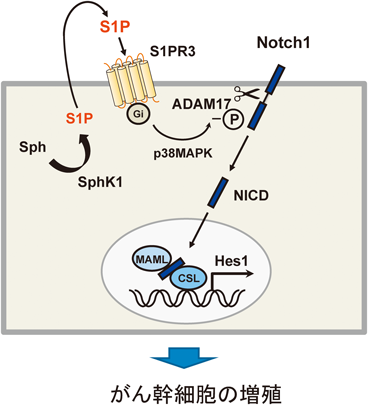
Notchの活性化は,一般的には隣接した細胞間でNotchリガンドとNotchが結合することにより引き起こされる.その後,NotchはADAMメタロプロテイナーゼやγセクレターゼによって切断され,産生されたNICDが核内に移行して,HesやHeyなどの遺伝子ファミリーを活性化してシグナルが伝達される.非常に興味深いことに,S1PによるNotchの活性化はNotchリガンド(DLL1, 3, 4およびJagged1, 2)に対するsiRNAで抑制されなかったことから,Notchリガンド非依存的なメカニズムであることが推定された.そこで,Notchの切断酵素を検討したところ,S1Pの刺激によってp38MAPKがADAM17の細胞内領域の735番目のセリンをリン酸化することによりADAM17が活性化されてNICDが産生されるメカニズムを明らかにした(図2).具体的なNotchの切断様式はまだ不明であるが,Notchリガンドを介さず細胞内シグナルを介した新たなNotch活性化機構を示唆するものである.臨床検体由来の乳がん幹細胞において,S1PR3, ADAM17, NICDは同じ細胞に発現していることを確認しており,S1PとNotchのクロストークが示唆される.
今回紹介した以外にもNotchリガンド非依存的なNotch活性化経路が報告されているが12),Notchリガンド依存的と非依存的なシグナルの使い分け,機能的な違いは明らかになっていない.Notchリガンドは上記の5種類,NotchのサブタイプはNotch1~4の4種類あり,組み合わせにより生理的な機能も多岐にわたると考えられるが,かなりの組み合わせ数に上るため解析を困難にしている.Notch活性化に対するリガンド依存性に関して,筆者らはADAMのサブタイプの違いに着目して解析を進めている.ADAM17の過剰発現によりがん幹細胞の増殖が誘導されるが,ADAM10では認められないなどサブタイプにより違いがあり,今後さらに詳細に検討したい.
最近,微小環境における乳がん幹細胞の機能解析も進んでいる.がん幹細胞とストローマの相互作用のメカニズムとして,腫瘍中のストローマ細胞に発現しているJagged1が乳がん細胞におけるNotch3に作用して乳がん幹細胞の増殖が誘導されるモデルが報告された13).乳がんは周囲の環境によってNotch活性化機構が異なる可能性があり,さらなる解析が必要である.
がん幹細胞の発見によってがんの治療薬も変革が求められている.これまで長年使用されてきたヒトがん培養細胞株パネルはヒトの病態とのかい離が指摘されており,臨床検体由来の細胞を動物に移植するpatient-derived xenograft(PDX)モデルなどが求められている.従来のがん細胞に対する薬剤のみではがん幹細胞が生き残り,再発する可能性があることから,がん幹細胞を標的とする薬剤の開発もきわめて重要である.
がん幹細胞同定(濃縮)法の進展により,新規の創薬標的分子が同定され,創薬応用が期待される.in vitroのハイスループットなアッセイ系が確立され,大規模な化合物のスクリーニングも進められている14).これらの多くは細胞株を用いて見いだされたものであるため,実際に臨床サンプルを用いて標的候補分子に対する薬剤の効果を検証する必要があり,ヒトがん幹細胞の細胞パネルなどリソースの整備も今後の課題である.
しかしながら,がん幹細胞は純化されておらず,実体の解明はまだ道半ばである.臨床検体も個々にin vitro解析が行われているが,多様な表現型と臨床情報の相関は単純ではない.またPDXモデルはヒトがん組織構造体の不均一性を反映したモデルとして期待されているが,微小環境は動物由来でありヒトの病態の反映という観点でも限界があり注意が必要である.さらに,がん幹細胞の起源については各組織の幹細胞が変異によってがん細胞化するという説が唱えられているが,いまだ解明されていない.最近,がん細胞が脱分化してがん幹細胞化する可能性が示唆されており15),がん細胞の可塑性も考慮する必要があり,がん幹細胞を標的とする薬剤の実現には困難も予想される.
本稿では,主に脂質によるがん幹細胞の制御機構を概説した.現在,がん幹細胞の分野は非常に注目を集めて精力的に研究が進められており,幹細胞性を維持するシグナル伝達機構もかなり明らかになりつつある.引き続き,ゲノム,エピゲノム,トランスクリプト—ム,メタボロームなどのオミックス解析により,新たな情報が得られることが期待される.また,今回は詳しくふれていないが,PDXモデルやがんの微小環境も重要なポイントであろう.今後,がん幹細胞の特性や標的候補分子が解明されて,革新的な創薬や臨床応用が実現し,がんの根治につながることを期待したい.
謝辞Acknowledgments
国立医薬品食品衛生研究所・薬理部および有機化学部の皆様に御礼申し上げます.
引用文献References
1) Beck, B. & Blanpain, C. (2013) Nat. Rev. Cancer, 13, 727–738.
2) Bonnet, D. & Dick, J.E. (1997) Nat. Med., 3, 730–737.
3) Kanda, Y.(2012) in Clinical Flow Cytometry - Emerging Applications, pp. 107–124, InTech, Rijeka, Croatia.
4) Ginestier, C., Hur, M.H., Charafe-Jauffret, E., Monville, F., Dutcher, J., Brown, M., Jacquemier, J., Viens, P., Kleer, C.G., Liu, S., Schott, A., Hayes, D., Birnbaum, D., Wicha, M.S., & Dontu, G. (2007) Cell Stem Cell, 1, 555–567.
5) Tsang, J.Y., Huang, Y.H., Luo, M.H., Ni, Y.B., Chan, S.K., Lui, P.C., Yu, A.M., Tan, P.H., & Tse, G.M. (2012) Breast Cancer Res. Treat., 136, 407–417.
6) Ben-Porath, I., Thomson, M.W., Carey, V.J., Ge, R., Bell, G.W., Regev, A., & Weinberg, R.A. (2008) Nat. Genet., 40, 499–507.
7) Hirata, N., Sekino, Y., & Kanda, Y. (2010) Biochem. Biophys. Res. Commun., 403, 138–143.
8) Hirata, N., Yamada, S., Syoda, T., Kurihara, M., Sekino, Y., & Kanda, Y. (2014) Nat. Commun., 5, 4806.
9) Pyne, N.J. & Pyne, S. (2010) Nat. Rev. Cancer, 10, 489–503.
10) Seo, E.J., Kwon, Y.W., Jang, I.H., Kim, D.K., Lee, S.I., Choi, E.J., Kim, K.H., Suh, D.S., Lee, J.H., Choi, K.U., Lee, J.W., Mok, H.J., Kim, K.P., Matsumoto, H., Aoki, J., & Kim, J.H. (2016) Stem Cells, 34, 551–564.
11) Bendall, L.J. & Basnett, J. (2013) Curr. Opin. Hematol., 20, 281–288.
12) Palmer, W.H. & Deng, W.M. (2015) Trends Cell Biol., 25, 697–707.
13) Boelens, M.C., Wu, T.J., Nabet, B.Y., Xu, B., Qiu, Y., Yoon, T., Azzam, D.J., Twyman-Saint Victor, C., Wiemann, B.Z., Ishwaran, H., Ter Brugge, P.J., Jonkers, J., Slingerland, J., & Minn, A.J. (2014) Cell, 159, 499–513.
14) Gupta, P.B., Onder, T.T., Jiang, G., Tao, K., Kuperwasser, C., Weinberg, R.A., & Lander, E.S. (2009) Cell, 138, 645–659.
15) Chaffer, C.L., Brueckmann, I., Scheel, C., Kaestli, A.J., Wiggins, P.A., Rodrigues, L.O., Brooks, M., Reinhardt, F., Su, Y., Polyak, K., Arendt, L.M., Kuperwasser, C., Bierie, B., & Weinberg, R.A. (2011) Proc. Natl. Acad. Sci. USA, 109, 7950–7955.
著者紹介Author Profile
 諫田 泰成(かんだ やすなり)
諫田 泰成(かんだ やすなり)国立医薬品食品衛生研究所・安全性生物試験研究センター・薬理部・部長.博士(薬学).
略歴1993年東京大学薬学部卒業,97年東京大学大学院薬学系研究科博士課程を中退し,同年防衛医科大学校薬理学講座助手.米国ピッツバーグ大学・幹細胞研究センターの留学を経て,2008年より国立医薬品食品衛生研究所・安全性生物試験研究センター・薬理部・室長.2017年より同部長.
研究テーマと抱負がん幹細胞,iPS細胞など様々なヒト幹細胞を用いて,創薬への応用を目指しています.特に,がんなどの疾患に対する新たな治療薬の基盤技術の確立ならびに医薬品や化学物質の安全性評価の開発と国際標準化に取り組むことにより,健康で安心なくらしに貢献したいと思っております.
趣味旅行,スポーツ観戦,子育て.