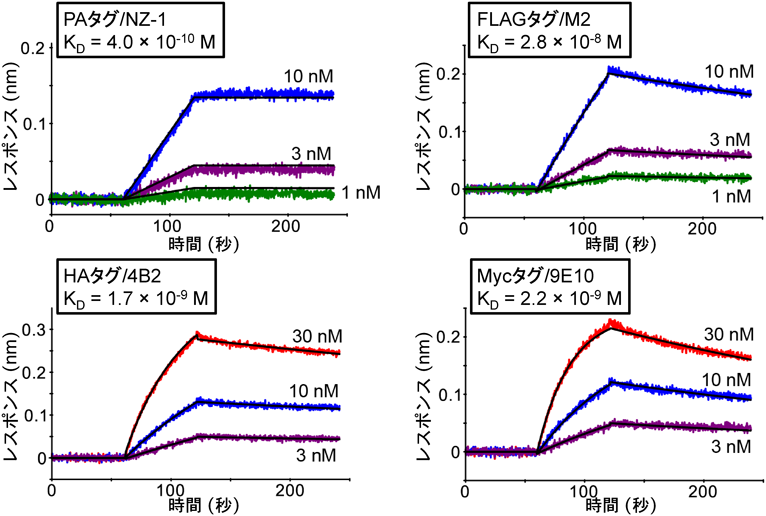
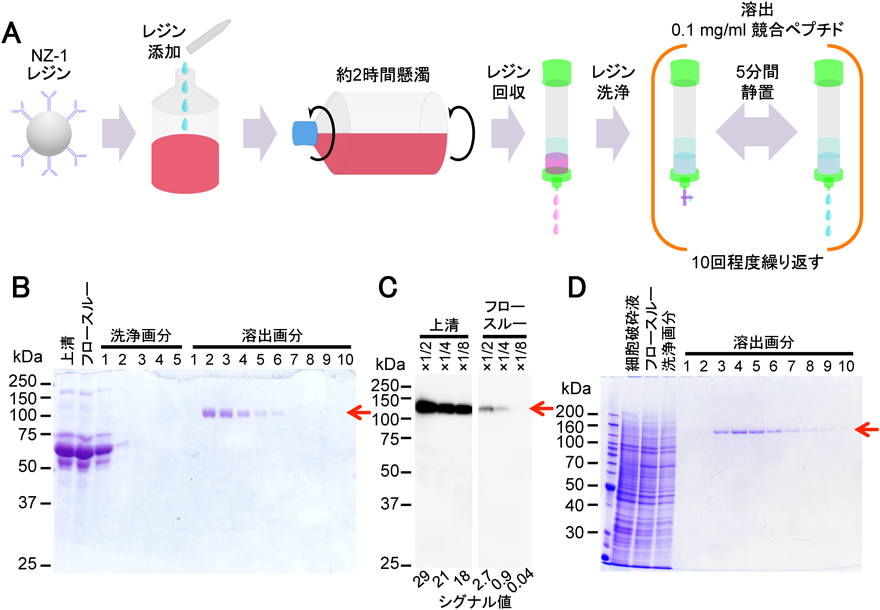
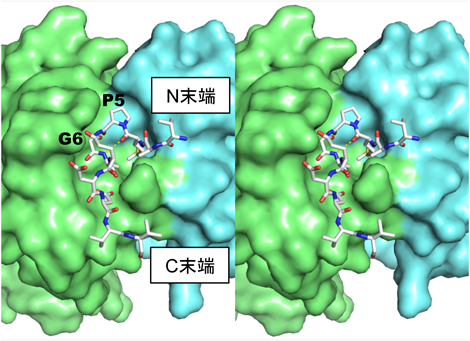
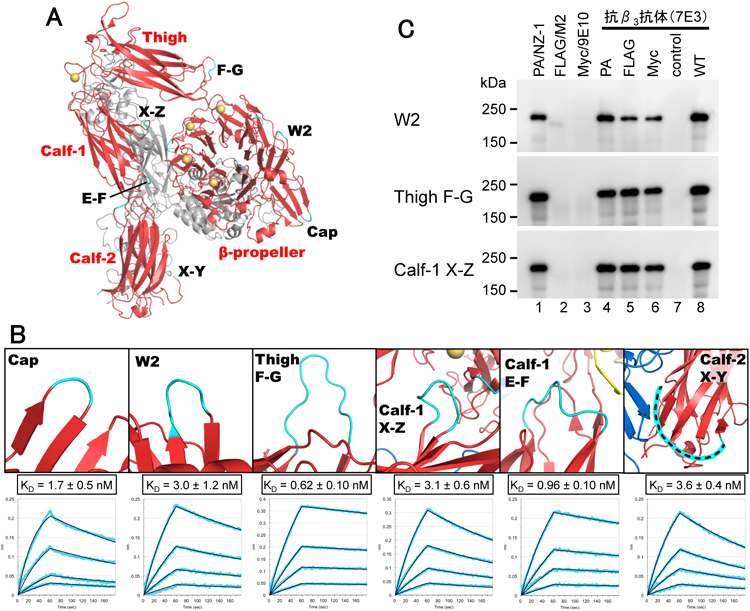
超高親和性タグ“PAタグ”によるタンパク質精製およびその発展的利用法Highly pure protein purification method and developmental application using PA tag system with a super high affinity
東北大学大学院医学系研究科Tohoku University Graduate School of Medicine ◇ 〒980–8575 宮城県仙台市青葉区星陵町2–1 ◇ 2–1 Seiryo-machi, Aoba-ku Sendai Miyagi 980–8575, Japan