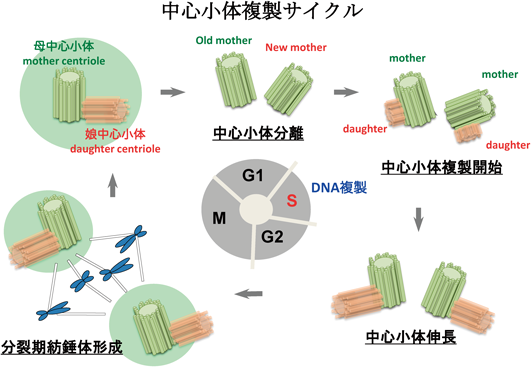
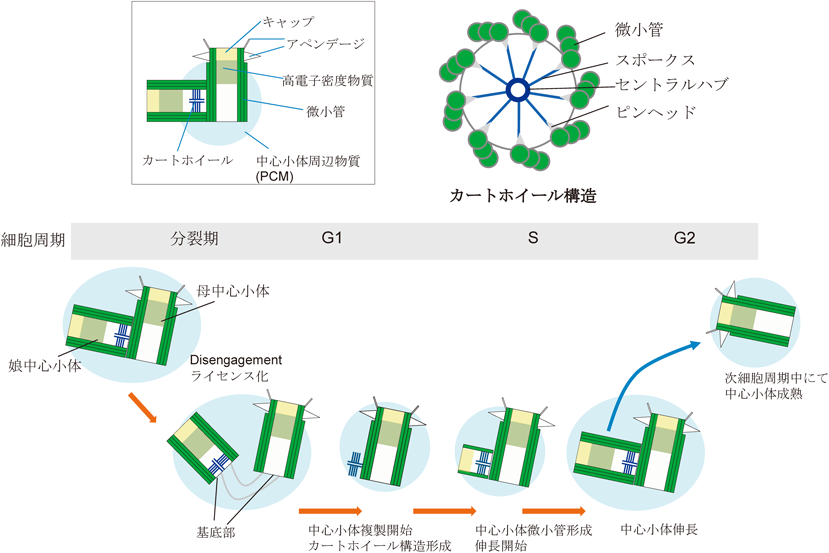
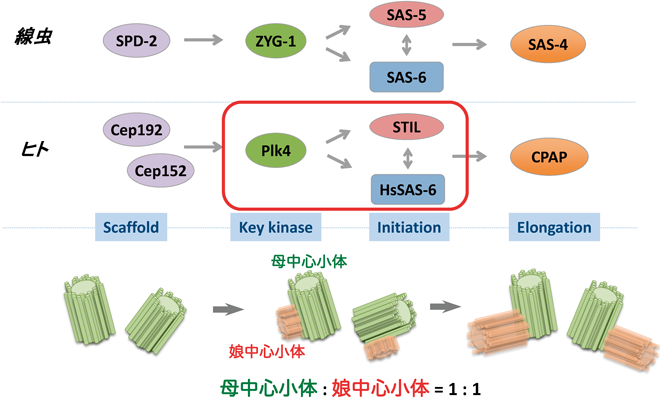
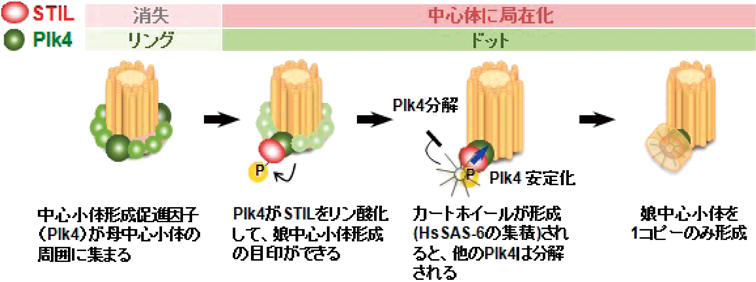
4) Gönczy, P., Echeverri, C., Oegema, K., Coulson, A., Jones, S.J., Copley, R.R., Duperon, J., Oegema, J., Brehm, M., Cassin, E., Hannak, E., Kirkham, M., Pichler, S., Flohrs, K., Goessen, A., Leidel, S., Alleaume, A.M., Martin, C., Ozlü, N., Bork, P., & Hyman, A.A. (2000) Nature, 408, 331–336.
5) Sonnichsen, B., Koski, L.B., Walsh, A., Marschall, P., Neumann, B., Brehm, M., Alleaume, A.M., Artelt, J., Bettencourt, P., Cassin, E., Hewitson, M., Holz, C., Khan, M., Lazik, S., Martin, C., Nitzsche, B., Ruer, M., Stamford, J., Winzi, M., Heinkel, R., Röder, M., Finell, J., Häntsch, H., Jones, S.J., Jones, M., Piano, F., Gunsalus, K.C., Oegema, K., Gönczy, P., Coulson, A., Hyman, A.A., & Echeverri, C.J. (2005) Nature, 434, 462–469.
6) Kemp, C.A., Kopish, K.R., Zipperlen, P., Ahringer, J., & O’Connell, K.F. (2004) Dev. Cell, 6, 511–523.
7) Kemp, C.A., Song, M.H., Addepalli, M.K., Hunter, G., & O’Connell, K. (2007) Genetics, 176, 95–113.
8) Delattre, M., Leidel, S., Wani, K., Baumer, K., Bamat, J., Schnabel, H., Feichtinger, R., Schnabel, R., & Gönczy, P. (2004) Nat. Cell Biol., 6, 656–664.
9) Leidel, S., Delattre, M., Cerutti, L., Baumer, K., & Gönczy, P. (2005) Nat. Cell Biol., 7, 115–125.
13) Pelletier, L., O’Toole, E., Schwager, A., Hyman, A.A., & Müller-Reichert, T. (2006) Nature, 444, 619–623.
14) Sugioka, K., Hamill, D.R., Lowry, J.B., McNeely, M.E., Enrick, M., Richter, A.C., Kiebler, L.E., Priess, J.R., & Bowerman, B. (2017) eLife, 6, e20353.
16) Kitagawa, D., Flückiger, I., Polanowska, J., Keller, D., Reboul, J., & Gönczy, P. (2011) Dev. Cell, 20, 550–562.
17) Strnad, P., Leidel, S., Vinogradova, T., Euteneuer, U., Khodjakov, A., & Gönczy, P. (2007) Dev. Cell, 13, 203–213.
18) Kleylein-Sohn, J., Westendorf, J., Le Clech, M., Habedanck, R., Stierhof, Y.D., & Nigg, E.A. (2007) Dev. Cell, 13, 190–202.
20) Kitagawa, D., Vakonakis, I., Olieric, N., Hilbert, M., Keller, D., Olieric, V., Bortfeld, M., Erat, M.C., Flückiger, I., Gönczy, P., & Steinmetz, M.O. (2011) Cell, 144, 364–375.
21) van Breugel, M., Hirono, M., Andreeva, A., Yanagisawa, H.A., Yamaguchi, S., Nakazawa, Y., Morgner, N., Petrovich, M., Ebong, I.O., Robinson, C.V., Johnson, C.M., Veprintsev, D., & Zuber, B. (2011) Science, 331, 1196–1199.
22) van Breugel, M., Wilcken, R., McLaughlin, S.H., Rutherford, T.J., & Johnson, C.M. (2014) eLife, 3, e01812.
23) Kitagawa, D., Kohlmaier, G., Keller, D., Strnad, P., Balestra, F.R., Flückiger, I., & Gönczy, P. (2011) J. Cell Sci., 124, 3884–3893.
24) Tang, C.J., Lin, S.Y., Hsu, W.B., Lin, Y.N., Wu, C.T., Lin, Y.C., Chang, C.W., Wu, K.S., & Tang, T.K. (2011) EMBO J., 30, 4790–4804.
25) Ohta, M., Ashikawa, T., Nozaki, Y., Kozuka-Hata, H., Goto, H., Inagaki, M., Oyama, M., & Kitagawa, D. (2014) Nat. Commun., 5, 5267.
26) Dzhindzhev, N.S., Tzolovsky, G., Lipinszki, Z., Schneider, S., Lattao, R., Fu, J., Debski, J., Dadlez, M., & Glover, D.M. (2014) Curr. Biol., 24, 2526–2532.
28) Moyer, T.C., Clutario, K.M., Lambrus, B.G., Daggubati, V., & Holland, A.J. (2015) J. Cell Biol., 209, 863–878.
29) Arquint, C., Gabryjonczyk, A.M., Imseng, S., Böhm, R., Sauer, E., Hiller, S., Nigg, E.A., & Maier, T. (2015) eLife, 4.
30) Tsuchiya, Y., Yoshiba, S., Gupta, A., Watanabe, K., & Kitagawa, D. (2016) Nat. Commun., 7, 12567.
32) Fu, J., Lipinszki, Z., Rangone, H., Min, M., Mykura, C., Chao-Chu, J., Schneider, S., Dzhindzhev, N.S., Gottardo, M., Riparbelli, M.G., Callaini, G., & Glover, D.M. (2016) Nat. Cell Biol., 18, 87–99.
33) Chang, C.W., Hsu, W.B., Tsai, J.J., Tang, C.J., & Tang, T.K. (2016) J. Cell Sci., 129, 2501–2513.
34) Saurya, S., Roque, H., Novak, Z.A., Wainman, A., Aydogan, M.G., Volanakis, A., Sieber, B., Pinto, D.M., & Raff, J.W. (2016) J. Cell Sci., 129, 2514–2525.
35) Guichard, P., Desfosses, A., Maheshwari, A., Hachet, V., Dietrich, C., Brune, A., Ishikawa, T., Sachse, C., & Gönczy, P. (2012) Science, 337, 553.