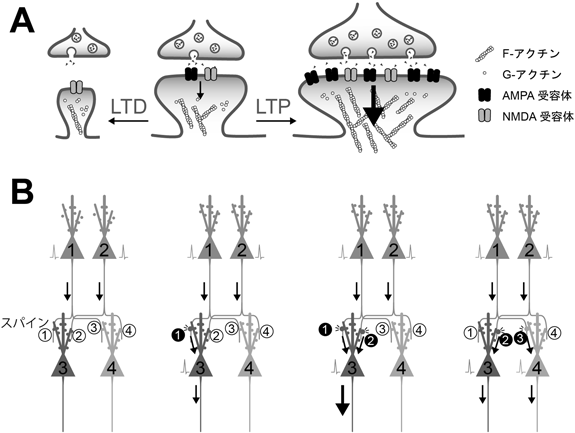
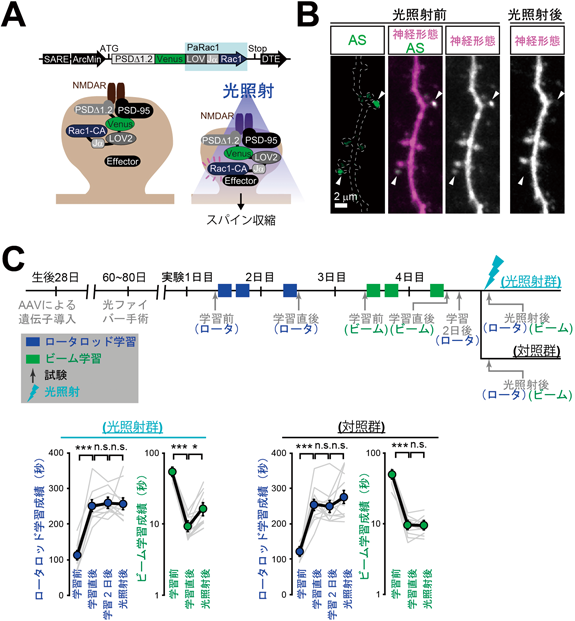
学習・記憶の細胞基盤:シナプス・アンサンブルSynaptic ensemble underlying learning and memory
1 群馬大学・生体調節研究所・脳病態制御分野Lab of Medical Neuroscience, Institute for Molecular and Cellular Regulation, Gunma University ◇ 〒371–8512 群馬県前橋市昭和町3–39–15 ◇ 3–39–15 Showa-machi, Maebashi city, Gunma 371–8512, Japan
2 JST・さきがけJST·Presto