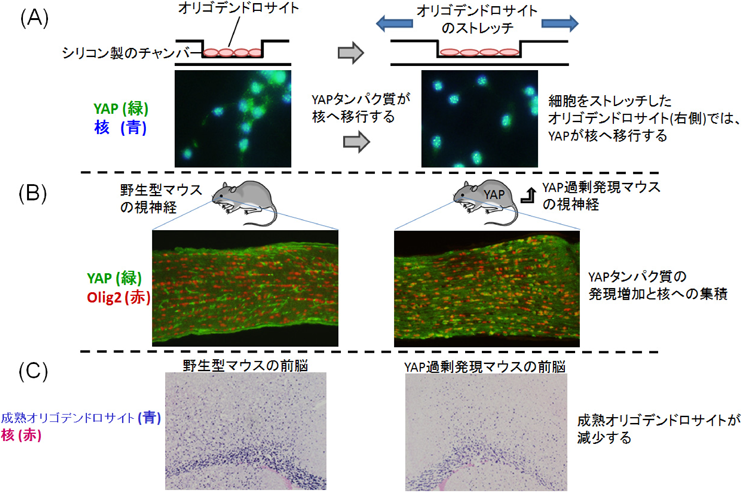
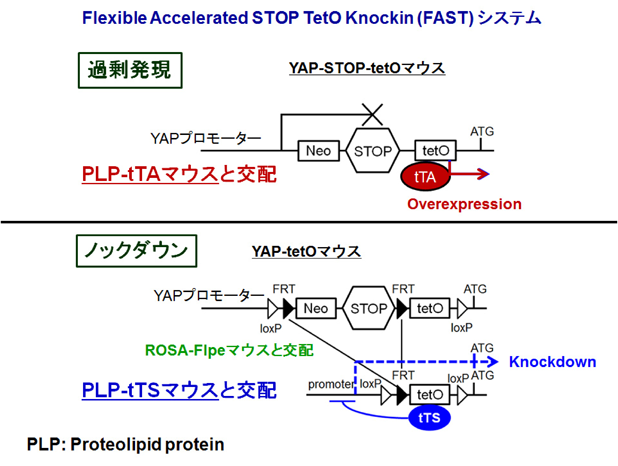
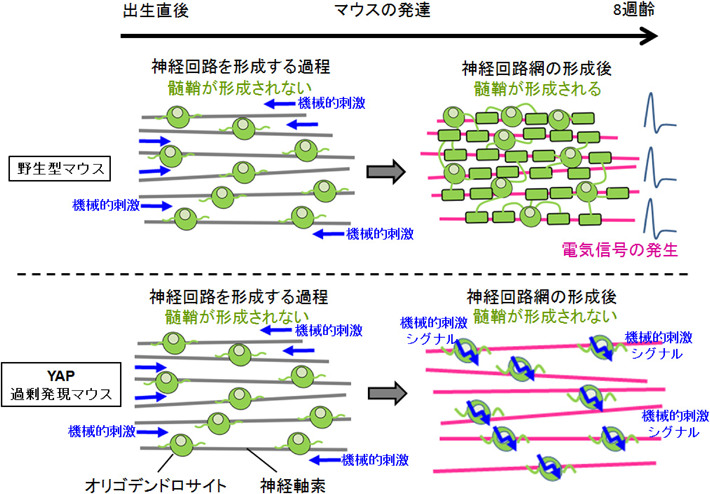
YAP因子を介したメカニカルストレスによるミエリン形成制御機構YAP functions as a mechanotransducer in oligodendrocyte morphogenesis and maturation
自然科学研究機構生理学研究所分子神経生理National Institute for Physiological Sciences (NIPS) Division of Neurobiology and Bioinformatics ◇ 〒444–8787 愛知県岡崎市明大寺町字東山5–1 山手2号館7階 ◇ 5–1 Higashiyama-Azana, Myodaiji, Okazaki, Aichi 444–8787, Japan