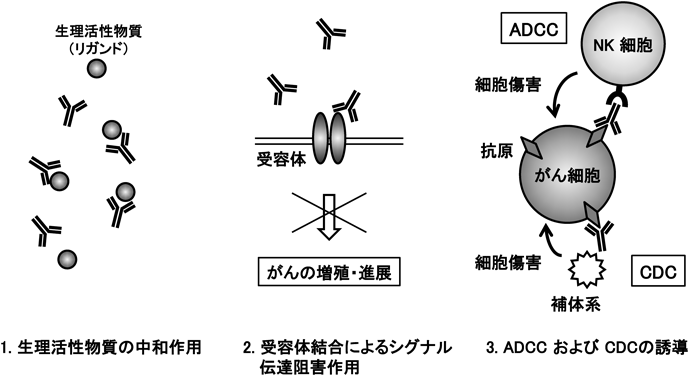
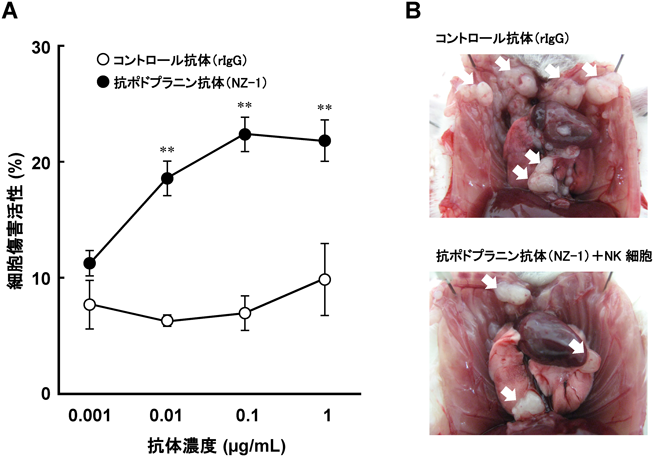
ポドプラニンを標的とした悪性胸膜中皮腫に対する新規抗体医薬開発Development of novel anti-podoplanin antibodies against malignant pleural mesothelioma
1 徳島大学大学院医歯薬学研究部呼吸器・膠原病内科学分野Department of Respiratory Medicine and Rheumatology, Institute of Biomedical Sciences, Tokushima University Graduate School ◇ 〒770–8503 徳島県徳島市蔵本町3丁目18番地の15 ◇ 3–18–15 Kuramoto-cho, Tokushima 770–8503
2 徳島大学大学院医歯薬学研究部臨床薬学実務教育学分野Department of Clinical Pharmacy Practice Pedagogy, Institute of Biomedical Sciences, Tokushima University Graduate School ◇ 〒770–8505 徳島県徳島市庄町1丁目78番地の1 ◇ 1–78–1 Sho-machi, Tokushima 770–8505