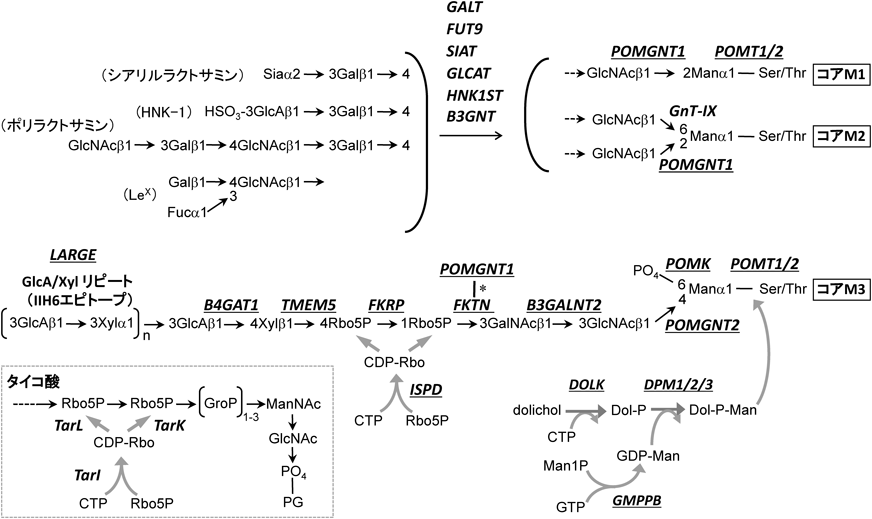
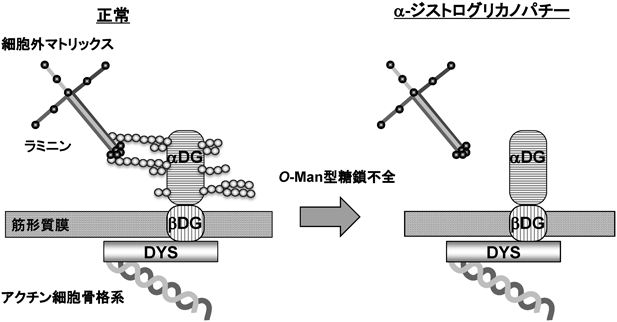
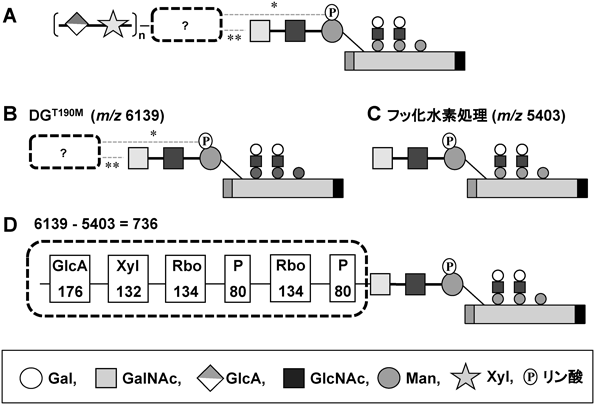
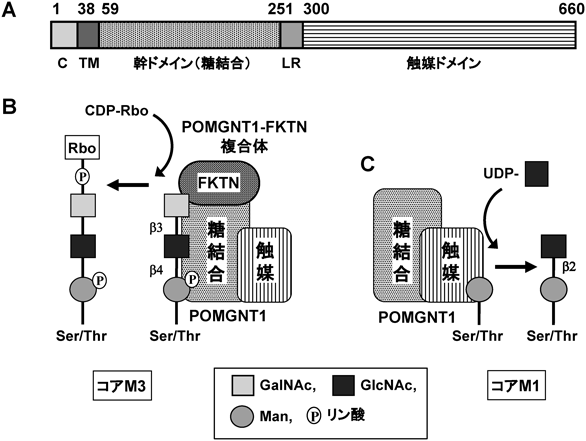
1) Chiba, A., Matsumura, K., Yamada, H., Inazu, T., Shimizu, T., Kusunoki, S., Kanazawa, I., Kobata, A., & Endo, T. (1997) J. Biol. Chem., 272, 2156–2162.
3) Yoshida, A., Kobayashi, K., Manya, H., Taniguchi, K., Kano, H., Mizuno, M., Inazu, T., Mitsuhashi, H., Takahashi, S., Takeuchi, M., Herrmann, R., Straub, V., Talim, B., Voit, T., Topaloglu, H., Toda, T., & Endo, T. (2001) Dev. Cell, 1, 717–724.
4) Manya, H. & Endo, T. (2015) in Sugar Chains: Decoding the Functions of Glycans (Suzuki, T., Ohtsubo, K., & Taniguchi, N. eds.), pp. 235–258, Springer Japan, Tokyo.
5) Kanagawa, M., Kobayashi, K., Tajiri, M., Manya, H., Kuga, A., Yamaguchi, Y., Akasaka-Manya, K., Furukawa, J., Mizuno, M., Kawakami, H., Shinohara, Y., Wada, Y., Endo, T., & Toda, T. (2016) Cell Reports, 14, 2209–2223.
6) Lommel, M., Winterhalter, P.R., Willer, T., Dahlhoff, M., Schneider, M.R., Bartels, M.F., Renner-Muller, I., Ruppert, T., Wolf, E., & Strahl, S. (2013) Proc. Natl. Acad. Sci. USA, 110, 21024–21029.
7) Vester-Christensen, M.B., Halim, A., Joshi, H.J., Steentoft, C., Bennett, E.P., Levery, S.B., Vakhrushev, S.Y., & Clausen, H. (2013) Proc. Natl. Acad. Sci. USA, 110, 21018–21023.
8) Endo, T. (2007) Acta Myol., 26, 165–170.
12) Peng, H.B., Ali, A.A., Daggett, D.F., Rauvala, H., Hassell, J.R., & Smalheiser, N.R. (1998) Cell Adhes. Commun., 5, 475–489.
14) Sugita, S., Saito, F., Tang, J., Satz, J., Campbell, K., & Sudhof, T.C. (2001) J. Cell Biol., 154, 435–445.
15) Sato, S., Omori, Y., Katoh, K., Kondo, M., Kanagawa, M., Miyata, K., Funabiki, K., Koyasu, T., Kajimura, N., Miyoshi, T., Sawai, H., Kobayashi, K., Tani, A., Toda, T., Usukura, J., Tano, Y., Fujikado, T., & Furukawa, T. (2008) Nat. Neurosci., 11, 923–931.
16) Wright, K.M., Lyon, K.A., Leung, H., Leahy, D.J., Ma, L., & Ginty, D.D. (2012) Neuron, 76, 931–944.
17) Briggs, D.C., Yoshida-Moriguchi, T., Zheng, T., Venzke, D., Anderson, M.E., Strazzulli, A., Moracci, M., Yu, L., Hohenester, E., & Campbell, K.P. (2016) Nat. Chem. Biol., 12, 810–814.
18) Manya, H., Chiba, A., Yoshida, A., Wang, X., Chiba, Y., Jigami, Y., Margolis, R.U., & Endo, T. (2004) Proc. Natl. Acad. Sci. USA, 101, 500–505.
23) Manya, H., Suzuki, T., Akasaka-Manya, K., Ishida, H.K., Mizuno, M., Suzuki, Y., Inazu, T., Dohmae, N., & Endo, T. (2007) J. Biol. Chem., 282, 20200–20206.
24) Larsen, I.S.B., Narimatsu, Y., Joshi, H.J., Yang, Z., Harrison, O.J., Brasch, J., Shapiro, L., Honig, B., Vakhrushev, S.Y., Clausen, H., & Halim, A. (2017) J. Biol. Chem., 292, 11586–11598.
26) Lefeber, D.J., Schonberger, J., Morava, E., Guillard, M., Huyben, K.M., Verrijp, K., Grafakou, O., Evangeliou, A., Preijers, F.W., Manta, P., Yildiz, J., Grunewald, S., Spilioti, M., van den Elzen, C., Klein, D., Hess, D., Ashida, H., Hofsteenge, J., Maeda, Y., van den Heuvel, L., Lammens, M., Lehle, L., & Wevers, R.A. (2009) Am. J. Hum. Genet., 85, 76–86.
27) Lefeber, D.J., de Brouwer, A.P., Morava, E., Riemersma, M., Schuurs-Hoeijmakers, J.H., Absmanner, B., Verrijp, K., van den Akker, W.M., Huijben, K., Steenbergen, G., van Reeuwijk, J., Jozwiak, A., Zucker, N., Lorber, A., Lammens, M., Knopf, C., van Bokhoven, H., Grunewald, S., Lehle, L., Kapusta, L., Mandel, H., & Wevers, R.A. (2011) PLoS Genet., 7, e1002427.
28) Barone, R., Aiello, C., Race, V., Morava, E., Foulquier, F., Riemersma, M., Passarelli, C., Concolino, D., Carella, M., Santorelli, F., Vleugels, W., Mercuri, E., Garozzo, D., Sturiale, L., Messina, S., Jaeken, J., Fiumara, A., Wevers, R.A., Bertini, E., Matthijs, G., & Lefeber, D.J. (2012) Ann. Neurol., 72, 550–558.
29) Carss, K.J., Stevens, E., Foley, A.R., Cirak, S., Riemersma, M., Torelli, S., Hoischen, A., Willer, T., van Scherpenzeel, M., Moore, S.A., Messina, S., Bertini, E., Bonnemann, C.G., Abdenur, J.E., Grosmann, C.M., Kesari, A., Punetha, J., Quinlivan, R., Waddell, L.B., Young, H.K., Wraige, E., Yau, S., Brodd, L., Feng, L., Sewry, C., MacArthur, D.G., North, K.N., Hoffman, E., Stemple, D.L., Hurles, M.E., van Bokhoven, H., Campbell, K.P., Lefeber, D.J., Lin, Y.Y., & Muntoni, F.; UK10K Consortium. (2013) Am. J. Hum. Genet., 93, 29–41.
30) Yang, A.C., Ng, B.G., Moore, S.A., Rush, J., Waechter, C.J., Raymond, K.M., Willer, T., Campbell, K.P., Freeze, H.H., & Mehta, L. (2013) Mol. Genet. Metab., 110, 345–351.
31) Morise, J., Kizuka, Y., Yabuno, K., Tonoyama, Y., Hashii, N., Kawasaki, N., Manya, H., Miyagoe-Suzuki, Y., Takeda, S., Endo, T., Maeda, N., Takematsu, H., & Oka, S. (2014) Glycobiology, 24, 314–324.
32) Yaji, S., Manya, H., Nakagawa, N., Takematsu, H., Endo, T., Kannagi, R., Yoshihara, T., Asano, M., & Oka, S. (2015) Glycobiology, 25, 376–385.
33) Inamori, K., Endo, T., Ide, Y., Fujii, S., Gu, J., Honke, K., & Taniguchi, N. (2003) J. Biol. Chem., 278, 43102–43109.
34) Kaneko, M., Alvarez-Manilla, G., Kamar, M., Lee, I., Lee, J.K., Troupe, K., Zhang, W., Osawa, M., & Pierce, M. (2003) FEBS Lett., 554, 515–519.
35) Inamori, K., Endo, T., Gu, J., Matsuo, I., Ito, Y., Fujii, S., Iwasaki, H., Narimatsu, H., Miyoshi, E., Honke, K., & Taniguchi, N. (2004) J. Biol. Chem., 279, 2337–2340.
36) Lee, J.K., Matthews, R.T., Lim, J.M., Swanier, K., Wells, L., & Pierce, J.M. (2012) J. Biol. Chem., 287, 28526–28536.
37) Bleckmann, C., Geyer, H., Lieberoth, A., Splittstoesser, F., Liu, Y., Feizi, T., Schachner, M., Kleene, R., Reinhold, V., & Geyer, R. (2009) Biol. Chem., 390, 627–645.
40) Pacharra, S., Hanisch, F.G., Muhlenhoff, M., Faissner, A., Rauch, U., & Breloy, I. (2013) J. Proteome Res., 12, 1764–1771.
41) Yagi, H., Nakagawa, N., Saito, T., Kiyonari, H., Abe, T., Toda, T., Wu, S.W., Khoo, K.H., Oka, S., & Kato, K. (2013) Sci. Rep., 3, 3288.
42) Morita, I., Kakuda, S., Takeuchi, Y., Itoh, S., Kawasaki, N., Kizuka, Y., Kawasaki, T., & Oka, S. (2009) J. Biol. Chem., 284, 30209–30217.
44) Kanekiyo, K., Inamori, K., Kitazume, S., Sato, K., Maeda, J., Higuchi, M., Kizuka, Y., Korekane, H., Matsuo, I., Honke, K., & Taniguchi, N. (2013) J. Neurosci., 33, 10037–10047.
45) Yoshida-Moriguchi, T., Willer, T., Anderson, M.E., Venzke, D., Whyte, T., Muntoni, F., Lee, H., Nelson, S.F., Yu, L., & Campbell, K.P. (2013) Science, 341, 896–899.
46) Nagae, M., Mishra, S.K., Neyazaki, M., Oi, R., Ikeda, A., Matsugaki, N., Akashi, S., Manya, H., Mizuno, M., Yagi, H., Kato, K., Senda, T., Endo, T., Nogi, T., & Yamaguchi, Y. (2017) Genes Cells, 22, 348–359.
47) Manya, H., Yamaguchi, Y., Kanagawa, M., Kobayashi, K., Tajiri, M., Akasaka-Manya, K., Kawakami, H., Mizuno, M., Wada, Y., Toda, T., & Endo, T. (2016) J. Biol. Chem., 291, 24618–24627.
48) Praissman, J.L., Live, D.H., Wang, S., Ramiah, A., Chinoy, Z.S., Boons, G.J., Moremen, K.W., & Wells, L. (2014) eLife, 3, e03943.
49) Inamori, K., Yoshida-Moriguchi, T., Hara, Y., Anderson, M.E., Yu, L., & Campbell, K.P. (2012) Science, 335, 93–96.
51) Inamori, K., Hara, Y., Willer, T., Anderson, M.E., Zhu, Z., Yoshida-Moriguchi, T., & Campbell, K.P. (2013) Glycobiology, 23, 295–302.
52) Inamori, K.I., Beedle, A.M., de Bernabe, D.B., Wright, M.E., & Campbell, K.P. (2016) Glycobiology, 26, 1284–1296.
53) Yoshida-Moriguchi, T., Yu, L., Stalnaker, S.H., Davis, S., Kunz, S., Madson, M., Oldstone, M.B., Schachter, H., Wells, L., & Campbell, K.P. (2010) Science, 327, 88–92.
55) Roscioli, T., Kamsteeg, E.J., Buysse, K., Maystadt, I., van Reeuwijk, J., van den Elzen, C., van Beusekom, E., Riemersma, M., Pfundt, R., Vissers, L.E., Schraders, M., Altunoglu, U., Buckley, M.F., Brunner, H.G., Grisart, B., Zhou, H., Veltman, J.A., Gilissen, C., Mancini, G.M., Delree, P., Willemsen, M.A., Ramadza, D.P., Chitayat, D., Bennett, C., Sheridan, E., Peeters, E.A., Tan-Sindhunata, G.M., de Die-Smulders, C.E., Devriendt, K., Kayserili, H., El-Hashash, O.A., Stemple, D.L., Lefeber, D.J., Lin, Y.Y., & van Bokhoven, H. (2012) Nat. Genet., 44, 581–585.
56) Willer, T., Lee, H., Lommel, M., Yoshida-Moriguchi, T., de Bernabe, D.B., Venzke, D., Cirak, S., Schachter, H., Vajsar, J., Voit, T., Muntoni, F., Loder, A.S., Dobyns, W.B., Winder, T.L., Strahl, S., Mathews, K.D., Nelson, S.F., Moore, S.A., & Campbell, K.P. (2012) Nat. Genet., 44, 575–580.
57) Kobayashi, K., Nakahori, Y., Miyake, M., Matsumura, K., Kondo-Iida, E., Nomura, Y., Segawa, M., Yoshioka, M., Saito, K., Osawa, M., Hamano, K., Sakakihara, Y., Nonaka, I., Nakagome, Y., Kanazawa, I., Nakamura, Y., Tokunaga, K., & Toda, T. (1998) Nature, 394, 388–392.
58) Brockington, M., Blake, D.J., Prandini, P., Brown, S.C., Torelli, S., Benson, M.A., Ponting, C.P., Estournet, B., Romero, N.B., Mercuri, E., Voit, T., Sewry, C.A., Guicheney, P., & Muntoni, F. (2001) Am. J. Hum. Genet., 69, 1198–1209.
59) Brockington, M., Yuva, Y., Prandini, P., Brown, S.C., Torelli, S., Benson, M.A., Herrmann, R., Anderson, L.V., Bashir, R., Burgunder, J.M., Fallet, S., Romero, N., Fardeau, M., Straub, V., Storey, G., Pollitt, C., Richard, I., Sewry, C.A., Bushby, K., Voit, T., Blake, D.J., & Muntoni, F. (2001) Hum. Mol. Genet., 10, 2851–2859.
60) Willer, T., Inamori, K., Venzke, D., Harvey, C., Morgensen, G., Hara, Y., Beltran Valero de Bernabe, D., Yu, L., Wright, K.M., & Campbell, K.P. (2014) eLife, 3, e03941.
61) Kuwabara, N., Manya, H., Yamada, T., Tateno, H., Kanagawa, M., Kobayashi, K., Akasaka-Manya, K., Hirose, Y., Mizuno, M., Ikeguchi, M., Toda, T., Hirabayashi, J., Senda, T., Endo, T., & Kato, R. (2016) Proc. Natl. Acad. Sci. USA, 113, 9280–9285.
63) Xiong, H., Kobayashi, K., Tachikawa, M., Manya, H., Takeda, S., Chiyonobu, T., Fujikake, N., Wang, F., Nishimoto, A., Morris, G.E., Nagai, Y., Kanagawa, M., Endo, T., & Toda, T. (2006) Biochem. Biophys. Res. Commun., 350, 935–941.