4) Need, A.C., Shashi, V., Hitomi, Y., Schoch, K., Shianna, K.V., McDonald, M.T., Meisler, M.H., & Goldstein, D.B. (2012) J. Med. Genet., 49, 353–361.
5) Hosomi, A., Tanabe, K., Hirayama, H., Kim, I., Rao, H., & Suzuki, T. (2010) J. Biol. Chem., 285, 24324–24334.
7) Wiertz, E.J., Jones, T.R., Sun, L., Bogyo, M., Geuze, H.J., & Ploegh, H.L. (1996) Cell, 84, 769–779.
8) Funakoshi, Y., Negishi, Y., Gergen, J.P., Seino, J., Ishii, K., Lennarz, W.J., Matsuo, I., Ito, Y., Taniguchi, N., & Suzuki, T. (2010) PLoS One, 5, e10545.
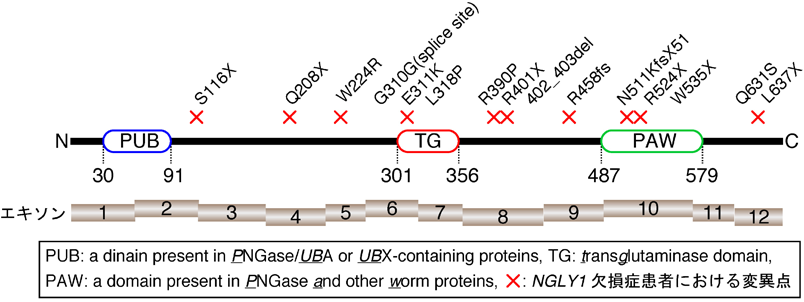
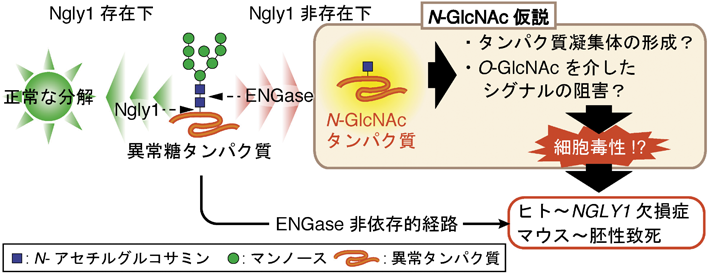
12) Fujihira, H., Masahara-Negishi, Y., Tamura, M., Huang, C., Harada, Y., Wakana, S., Takakura, D., Kawasaki, N., Taniguchi, N., Kondoh, G., Yamashita, T., Funakoshi, Y., & Suzuki, T. (2017) PLoS Genet., 13, e1006696.
13) Huang, C., Harada, Y., Hosomi, A., Masahara-Negishi, Y., Seino, J., Fujihira, H., Funakoshi, Y., Suzuki, T., Dohmae, N., & Suzuki, T. (2015) Proc. Natl. Acad. Sci. USA, 112, 1398–1403.
14) Fukuda, T., Hashimoto, H., Okayasu, N., Kameyama, A., Onogi, H., Nakagawasai, O., Nakazawa, T., Kurosawa, T., Hao, Y., Isaji, T., Tadano, T., Narimatsu, H., Taniguchi, N., & Gu, J. (2011) J. Biol. Chem., 286, 18434–18443.
15) Caglayan, A.O., Comu, S., Baranoski, J.F., Parman, Y., Kaymakcalan, H., Akgumus, G.T., Caglar, C., Dolen, D., Erson-Omay, E.Z., Harmanci, A.S., Mishra-Gorur, K., Freeze, H.H., Yasuno, K., Bilguvar, K., & Gunel, M. (2015) Eur. J. Med. Genet., 58, 39–43.
16) Enns, G.M., Shashi, V., Bainbridge, M., Gambello, M.J., Zahir, F.R., Bast, T., Crimian, R., Schoch, K., Platt, J., Cox, R., Bernstein, J.A., Scavina, M., Walter, R.S., Bibb, A., Jones, M., Hegde, M., Graham, B.H., Need, A.C., Oviedo, A., Schaaf, C.P., Boyle, S., Butte, A.J., Chen, R., Chen, R., Clark, M.J., Haraksingh, R., Consortium, F.C., Cowan, T.M., He, P., Langlois, S., Zoghbi, H.Y., Snyder, M., Gibbs, R.A., Freeze, H.H., & Goldstein, D.B. (2014) Genet. Med., 16, 751–758.
18) Lam, C., Ferreira, C., Krasnewich, D., Toro, C., Latham, L., Zein, W.M., Lehky, T., Brewer, C., Baker, E.H., Thurm, A., Farmer, C.A., Rosenzweig, S.D., Lyons, J.J., Schreiber, J.M., Gropman, A., Lingala, S., Ghany, M.G., Solomon, B., Macnamara, E., Davids, M., Stratakis, C.A., Kimonis, V., Gahl, W.A., & Wolfe, L. (2017) Genet. Med., 19, 160–168.
19) Bosch, D.G., Boonstra, F.N., de Leeuw, N., Pfundt, R., Nillesen, W.M., de Ligt, J., Gilissen, C., Jhangiani, S., Lupski, J.R., Cremers, F.P., & de Vries, B.B. (2016) Eur. J. Hum. Genet., 24, 660–665.