スフィンゴ糖脂質は「セラミド」と「糖鎖」部分からなる両親媒性の分子であり,疎水性の強いセラミド部分を細胞膜の脂質二重層外層にアンカーし,親水性の糖鎖部位を外側に突出した形で発現している.スフィンゴ糖脂質の糖鎖部分は100種を超える構造多様性が存在し,その発現は細胞種ごとに厳密に制御されている.また,セラミド部分もスフィンゴシン塩基およびアシル鎖の炭素数・不飽和度の違い,水酸基の付加により多様な構造が存在する1).
スフィンゴ糖脂質は,さまざまな分子と特異的に相互作用し,生物学的機能を発揮している.糖鎖部分での相互作用には,細胞外から相手の分子が接近し作用する“トランス作用”と,同じ細胞膜上に発現する分子と作用する“シス作用”の2通りが想定される.特にシス作用では細胞膜上で発現する各種受容体などの膜タンパク質に直接的に相互作用しその機能,局在,安定性を制御するほか,間接的・直接的相互作用によって多様な分子とともに細胞膜上に“機能性微小膜領域”を形成することで細胞機能を制御していると考えられている.セラミド部分の構造もまた,他の細胞膜構成脂質およびタンパク質との相互作用や,細胞膜の物理化学的性質に関与すると考えられる.このようにスフィンゴ糖脂質は多様な作用方法によって複雑に生物機能を制御していると考えられる2–4).
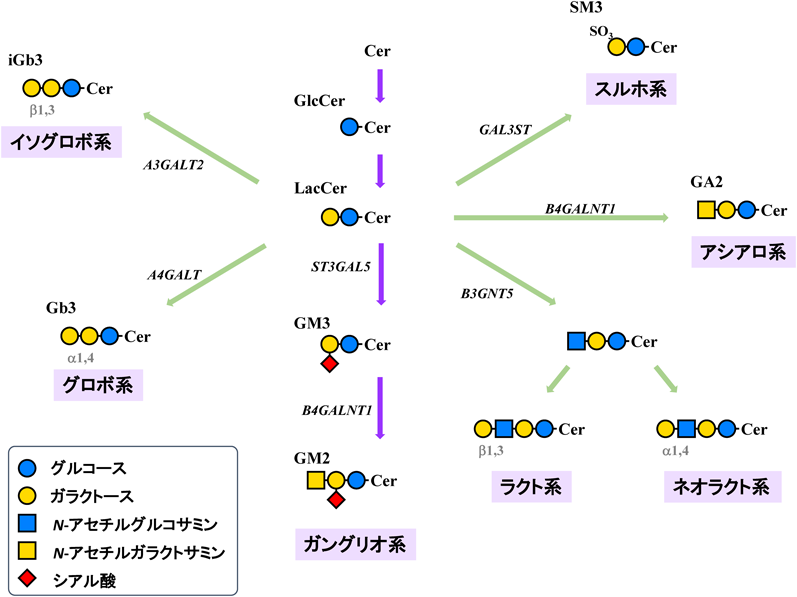
特にシアル酸を含有するスフィンゴ糖脂質をガングリオシドと総称する.その生合成は,GM3合成酵素(ST3GAL5)によってラクトシルセラミドにシアル酸が転移されることから始まる.その後順次糖が付加されてさまざまな構造のガングリオシドが生合成される(図1)5).これまで,ガングリオシドは各種成長因子の受容体などのタンパク質と相互作用することによって,細胞の増殖,分化,移動などを制御していることが多数報告されてきている6).
本稿では,近年見いだされてきたヒトにおけるガングリオシド欠損症の知見とガングリオシド合成酵素欠損マウスの症状をまとめ,そこからみえてきた新しいガングリオシドの機能を概説する.
ガングリオシドはその糖鎖構造中にシアル酸を含む酸性スフィンゴ糖脂質の総称である(図1).発見の経緯や,脳神経系に非常に多く存在していることから,長らく神経組織の形成や機能に必須であることが想定されてきた7, 8).
1990年代に入り,スフィンゴ糖脂質,ガングリオシド生合成に関わる酵素群のクローニングがなされ,各糖転移酵素遺伝子欠損マウスが作製され解析された5, 9–13).ほぼすべて(ガラクトシルセラミドから合成される一部の糖脂質を除く)のスフィンゴ糖脂質を欠損するグルコシルセラミド合成酵素14)およびラクトシルセラミド合成酵素の欠損マウスは胎生中期で致死となる15–17).これらの酵素を欠損した培養細胞は生存・増殖可能であることから,多様なスフィンゴ糖脂質構造は多細胞系の発達に明らかに必須である.
しかし驚くことに,神経系に多く存在し,重要な機能を担っていると考えられてきたガングリオシドを欠損させてもマウスは生まれてくる.我々のグループも含め,GM3合成酵素欠損マウスは一見明瞭な異常がなく,正常に成長し寿命にも大きな差はないことが報告されている18, 19).ただし,のちに詳細に述べる聴覚障害に加え,行動異常など種々の神経異常は確認されている19, 20).解析が進めば今後さらに一見してわからない表現型が明らかにされると考えられるが,想像以上に重篤な症状がないことに驚かされるものであった.GD3合成酵素欠損マウスも軽度の神経異常を呈するが重篤ではなく,生存にも大きな影響はない.GM2合成酵素欠損マウスも進行性の神経変性はみられるが,脳神経形成,生存に劇的な変化は確認されなかった21).これらのマウスの詳細な解析結果は,各ガングリオシドが神経組織の恒常性維持や再生,各種臓器における機能維持に関与していることを示しているが,当初の予想ほど神経組織形成や分化自体に影響がみられなかったことは驚きであった.これらの現象に関しては,特定の代謝経路の欠損により,代償的に増加するガングリオシドもしくはスフィンゴ糖脂質分子種が,欠損したガングリオシド分子種の機能をある程度代償をしているためと考えられる(図1,図4も参照).
これらの報告は,各ガングリオシド分子種固有の機能の存在を否定するものではない.いくつかのガングリオシドが有する非還元末端の共通構造が果たすことができる機能,厳密な特定糖鎖構造でしか果たせない機能,付加されているシアル酸の数(電荷数)によって制御される機能など,ガングリオシドが制御しうる生物機能にはさまざまな関与の形があることを示唆するものと考えられる.
これらのことから,ガングリオシド合成酵素ノックアウトマウスを用いた解析では,生体内のガングリオシド機能(消失したガングリオシドの機能)を真に反映しているのかという疑問が残ったままであった.現れた表現型は,ノックアウトによってガングリオシドが消失したことに起因するのか,代償的に増加・出現したスフィンゴ糖脂質の影響か,あるいは他の脂質とのバランスの破綻によるものか,真の答に迫るのは困難を要する問題である.
したがって単純にある特定のスフィンゴ糖脂質の糖鎖構造の合成を担う糖転移酵素のノックアウトマウスの解析だけでは,その糖脂質糖鎖構造の重要性をダイレクトに示すことは難しい.各スフィンゴ糖脂質欠損マウス(およびモデル生物)で発現する糖脂質の種類・量,表現型の詳細な解析,さまざまな種類の糖脂質改変モデル培養細胞株の作製・解析を行い,より多くの情報を集めることがますます必要となってくる.これらの情報を蓄積・統合していくことで,驚くような新たなスフィンゴ糖脂質機能の発見につながると考えられる.そのためには,各スフィンゴ糖脂質の代謝制御機構の解明,糖脂質改変技術(糖転移酵素遺伝子発現制御技術,合成酵素阻害剤開発),糖脂質化学合成技術(可視化用ラベル糖脂質),糖脂質検出技術(質量分析などの定性・定量法,抗体などの検出プローブ)などの技術開発,各研究分野との連携も非常に重要である.
また,近年ではエクソーム解析により原因未知の病気の原因遺伝子変異も見つけやすい環境になってきた.実際,近年これらの技術を用いて,新たなスフィンゴ糖脂質代謝関連遺伝子の変異が原因の疾患も見つかってきた.
ヒトにおけるガングリオシド分解酵素の変異による「蓄積症」は1930年代のGM2ガングリオシド—シスの発見以降22),多数報告されてきたものの23),ガングリオシド「生合成酵素の欠損」による症例は報告がなかった.
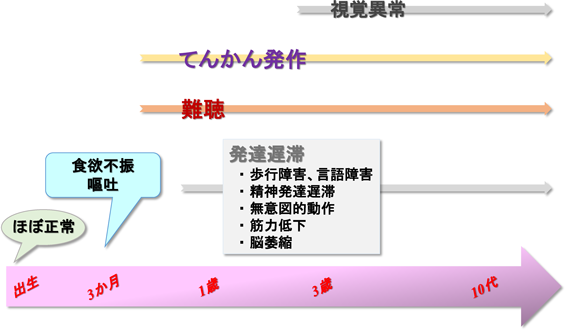
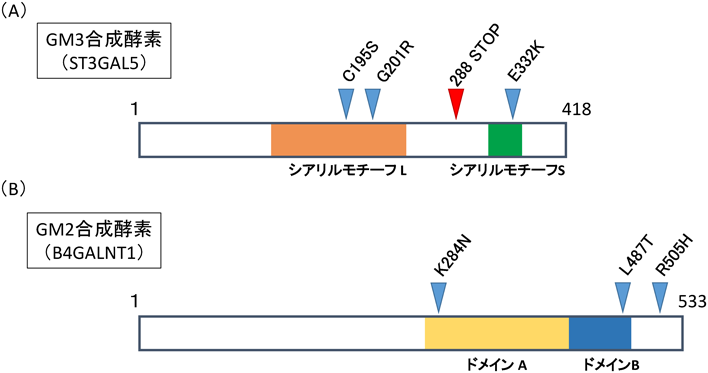
そんな中,2004年,アメリカのアーミッシュの中で,てんかん症状を示す子供のなかから,「GM3合成酵素(ST3GAL5)欠損」の症例が初めて発見された24)(図2).2013年にも新たにフランスのグループよりミトコンドリア呼吸鎖複合体欠損症様症状患者の遺伝子解析より,GM3合成酵素の変異が見つかり症例が報告された25).これらの症例ではST3GAL5のナンセンス変異が確認されている(図3).これらの報告のGM3欠損患者の血清中ではGM3以降のガングリオシドが完全に検出されなくなり,グロボ系,ネオラクト系の糖脂質が大幅に増加している.他の組織で同様のスフィンゴ糖脂質の変化が起きているか確認はとれていないが,患者から採取し培養した線維芽細胞でも同様にグロボ系スフィンゴ糖脂質の大幅な増加が確認されている.これらの患者ではてんかんの症状以外に,発育遅延,視神経萎縮および脳皮質の異常による視覚異常,精神発達遅滞,筋力低下,食欲不振,嘔吐などさまざまな症状およびミトコンドリアの呼吸鎖の異常が報告されている24–28)(図2,表1).
表1 ガングリオシド合成酵素欠損症の発見経緯・症状 | 変異 | 発見経緯・症状 | 文献 |
|---|
| ST3GAL5 | C195S, G201R | レット症候群様症状 | Leeら,2016 |
| E322K | ソルト&ペッパー症候群 | Buccutoら,2014 |
| R288 STOP | infantile-onset epilepsy症候群 | Simpsonら,2004 |
| | 筋低下 | |
| | 視覚異常 | |
| | 精神発達遅滞 | |
| | ミトコンドリア呼吸鎖複合体欠損症 | Fragakiら,2013 |
| | 色素異常 | Wangら,2013 |
| B4GALNT1 | K284N | 遺伝性痙性対麻痺 | Harlalkaら,2013 |
| L487T | | |
| R505H | | |
Boccutoらも2014年に「ソルト&ペッパー症候群」患者のSNPアレイ解析,エクソーム解析などから,アクセプター基質,ドナー基質両方との結合に関わるST3GAL5のシアリルモチーフS内のミスセンス変異[c.994G>A transition(p.E332K)]を同定した29).患者由来の線維芽細胞ではガングリオ系スフィンゴ糖脂質の消失,グロボ系スフィンゴ糖脂質の大幅な増加が確認されている.また,Boccutoらはこれらの線維芽細胞およびST3GAL5をノックダウンしたゼブラフィッシュにおいて,糖タンパク質N結合型およびO結合型の変化を見いだしている.特に,複合型糖鎖の増加,シアル酸修飾の増加傾向がみられる.これらがGM3欠損の代償機構なのかは定かではないが,病態に何らかの影響を及ぼしているものと考えられる.
また,近年韓国でもST3GAL5の欠損症例が報告された30).この症例では「レット症候群」様の症状を呈しており,生後まもなくの時期までは正常であるが,その後,精神遅滞やてんかん様症状などさまざまな症状が確認される.この報告の患者はST3GAL5のシアリルモチーフL内の複合ヘテロ接合性変異(p.Gly201Argとp.Cys195Ser)である.酵素活性測定は行われてはいないが,血清中のGM3, GD3は激減している.
また2013年には,遺伝性の神経変性疾患である遺伝性痙性対麻痺のエクソーム解析から,クウェート,イタリア,およびアーミッシュにおいてGM2合成酵素(B4ALNT1)の変異も報告された31).患者由来線維芽細胞の糖脂質解析ではGM2の消失,GM3の増加が確認されている.
ST3GAL5内の変異の場所ひいては活性の残存率や地域性によって症状の違いはあるものの,多くの場合,ST3GAL5の変異によってGM3以降のガングリオシドが欠失した場合,神経系機能に大きな影響が見いだされており,またB4ALNT1の変異によりGM2以降のガングリオシドが欠損した場合も神経変性を伴うことから,ヒトにおいて神経機能の維持にやはりガングリオシドが必須であることが示唆される.
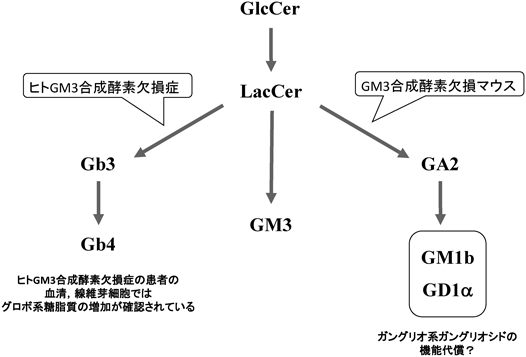
ここで生じる大きな疑問は,GM3合成酵素欠損マウスとヒトのGM3合成酵素欠損症ではその重篤度が大きく異なる点である.ここにガングリオシド,スフィンゴ糖脂質の新たな機能示唆が隠れていると考えられる.これまで筆者らを含めてGM3合成酵素欠損マウスでは各臓器でGM3以降の消失,加えて代償的にアシアロ系糖脂質が発現することを見いだしている19)(図4).GM3合成酵素欠損マウスが発現するアシアロ系糖脂質にはシアル酸を含有したGM1bやGD1α, GD1cがある.これらはGM3合成酵素欠損により消失したガングリオ系ガングリオシド(GM1やGD1a, GD1bなど)の異性体であり,これらが機能代償できる生命現象が多数あるものと考えている.
これに対し,ヒトのGM3合成酵素欠損症の血清,線維芽細胞ではガングリオ系の糖脂質の消失に加え,グロボ系糖脂質の増加が認められており,アシアロ系の糖脂質の増加は報告されていない24, 25, 32).この代償して発現するスフィンゴ糖脂質の違いがマウス,ヒト間の症状の違いに反映されている可能性が高い.
4. GM3合成酵素欠損マウスとGM3合成酵素欠損症の共通点
代償発現するスフィンゴ糖脂質分子種の違いはあるが,マウスとヒトにおいてGM3合成酵素欠損時,共通してみられる症状があれば,消失したガングリオシドの機能の本質である可能性が高いと考えた.
我々はGM3合成酵素欠損マウスが聴覚異常を有することを報告した19).その後の2013年にFragakiらの報告ではフランス系のGM3合成酵素欠損症の患者で聴覚異常の記載がなされた26).ただし,“hearing loss”の記載のみで,詳細は不明であった.そこで我々はアメリカペンシルバニア州ランカスターのアーミッシュの人々で運営される病院であるSpecial Clinic for childrenとの共同研究で,ST3GAL5 c.694C>T変異を持つ複数名のGM3合成酵素欠損患者の聴覚機能を聴性脳幹反応試験(ABR)で詳細に評価したところ,すべてのケースにおいて内耳蝸牛有毛細胞の機能異常が示唆された33).内耳の詳細な形態的解析は不可能であるため,GM3合成酵素欠損症の患者でどのような異常が内耳に起きているかは不明であるが,マウス,ヒト共通してGM3合成欠損の場合には聴覚機能に影響が出ることが明らかになった(Boccutoらの報告では聴覚に関して明確な記載はない.Leeらの報告では鎮静状態の維持が難しくABR試験ができなかったため,聴覚機能評価ができておらず,これらの患者の詳細な情報が期待される).
これらのことからガングリオシドが聴覚器官においてどのような細胞に発現しているか,GM3欠損時にどこに障害が出るかを解析し,聴覚におけるガングリオシドの機能を明らかにすることで,ガングリオシド,特にGM3の機能の本質がみえると考えた.
音波は外耳,中耳を経て,内耳の「蝸牛」へと伝えられる.蝸牛内の「コルチ器」が音波を神経信号に変換する.コルチ器は感覚細胞である1列の「内有毛細胞(inner hair cell:IHC)」および3~4列の「外有毛細胞(outer hair cell:OHC)とそれを支える支持細胞(supporting cell)からなる.有毛細胞はその上部に「聴毛(不動毛,stereocilia)」と呼ばれる規則正しく配列した微細な繊毛構造を有している.蝸牛内に伝わった音波によって,有毛細胞の聴毛との間で力学的ひずみが生じ,不動毛に発現するイオンチャネルが開きイオンが流入する.流入したイオンによって有毛細胞は脱分極を起こし神経伝達物質を放出する.このシグナルを蝸牛神経が受容し,電気信号として最終的に脳の聴覚野へと伝達され音として認識される.
マウスは生後,蝸牛内の細胞の形態的・機能的成熟を経て生後約14日目前後から聴覚が機能し始める.蝸牛の主要なガングリオシドはGM3である.生後まもなくのマウス蝸牛内のGM3の発現は微量であるが,生後14日目前後にかけての成熟期間に大幅にその量を増加させる.加えて複雑なガングリオシドも発現してくる.このことは,生後の蝸牛の機能的・形態的成熟,および維持にガングリオシドが重要な役割をしていることを示唆する.
特にGM3はコルチ器の内・外有毛細胞において細胞頂端側,聴毛において発現が強い(図5).GM3合成酵素欠損マウスでは,生後まもなく内有毛細胞および外有毛細胞の聴毛の変性が確認された.内有毛細胞では,いったん正常な細胞が形成されるが,生後10日目前後から聴毛どうしの融合が確認された.この変性した聴毛では聴毛内の難聴原因遺伝子産物のタンパク質の局在の変化・異常が確認されている.また,外有毛細胞の脱落も確認された.
内耳においてGM3とGD3のみを発現するGM2合成酵素欠損マウスでは生後14日前後でこのような聴覚異常,有毛細胞の変性はまったくみられないことから,細胞の極性形成,聴毛局在分子の輸送・局在決定にガングリオシドGM3が重要な役割を担っていることが強く示唆される33, 34).
ヒトGM3合成酵素欠損症の電気生理学的聴覚機能評価でも内外有毛細胞の異常が示唆されていることから,GM3合成酵素欠損時,マウスでみられた変化がヒトでも起きている可能性が高い.ヒトGM3合成酵素欠損症の症状,GM3合成酵素欠損マウス,GM2合成酵素欠損マウスを用いた病態解析,スフィンゴ糖脂質解析,組織形態解析で,内耳におけるGM3の機能にある程度迫ることはできたが,より詳細な分子機構・機能解明のため,今後モデル細胞などを用いた解析が必須になってくる.
解析手法や症例数の制限もあり,GM3合成酵素欠損マウスとGM3欠損症患者でみられた症状に類似した点は現在のところ少なく,不明な点が多い.共通して聴覚異常は判明したものの,やはりそれ以外にGM3合成酵素欠損マウスでは患者でみられた重篤な症状はみられていない.今後ヒト,マウスのGM3合成酵素欠損時,代償的に発現するスフィンゴ糖脂質の種類・量を精査し,症状との関連性を見いだしていく必要がある.また,我々はこれまでGM3がインスリンシグナルの制御に関与していることや,GM3合成酵素欠損マウスにおけるCD4+ T細胞の機能異常を報告しており35–38),現在も詳細な解析からGM3合成酵素欠損マウスにおいて新たな表現型を見いだしている.GM3欠損症患者でこれらの症状がみられるかを含め,今後,多角的な検証を行い,GM3機能の本質に迫りたい.
GM3合成酵素欠損患者では筋力の低下がみられ,車いすでの生活を余儀なくされる.この筋力低下は発育不全,栄養吸収の問題,神経機能異常などさまざまな要因が絡んだ複合的な要因であることが想定されるが,筋細胞の機能維持にGM3が重要であるとも考えられる.
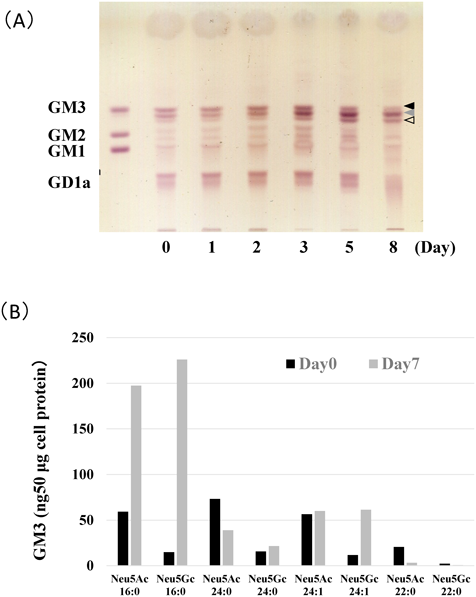
筆者らは最近,C2C12細胞を用いた筋分化モデルにおいて,GM3の新たな生物機能の可能性見いだした39).C2C12細胞はマウスサテライト細胞由来の筋芽細胞である.10%ウシ胎仔血清を含有する培地中では増殖するが,低血清(2%ウマ血清)にすることによって分化が誘導され,細胞融合し筋管を形成する.
C2C12細胞の分化過程のスフィンゴ糖脂質をTLC, HPLC, LC-MS/MSを用いて詳細に解析したところ,主要な糖脂質であるGM3の量的・質的変化を見いだした(図6).GM3量は分化に伴い大幅に増加するが,それに加えシアル酸分子種がNeu5AcからNeu5Gcへと変化した.加えて,GM3のセラミドのアシル鎖構造は分化前には炭素数24のものが主要であったのに対し,分化に伴い炭素数16のアシル鎖を持ったGM3が増加し,筋管形成後は炭素数16のアシル鎖を持ったNe5Gc-GM3が主要なものとなった.つまり,筋分化過程においてGM3の量的増加と微細構造の変化とが同時並行して起こり,同じGM3であっても分化に伴い極性が高い分子種へと変化してゆく.このGM3の量的・質的変化は筋分化および分化後の筋肉の質の制御に重要である可能性を示す結果を得ている39).
現在のところ,GM3合成酵素欠損マウスはほぼ正常に生まれて生育し,体重にも大きな差はないことから,筋肉の発生に関してはおおむね行われていると考えている.現在,筋損傷時の再生の面や機能的な面に関して詳細に解析を行っている.
こういった,培養モデル細胞系を用いたガングリオシドの生化学的な解析知見,分子レベルでの機能解析知見は,さまざまな報告が蓄積されている.ガングリオシド代謝遺伝子改変マウスや新たに報告されてきたヒトにおける欠損症の知見が集まり始めた現在,これらの知見を照らし合わせ,類似点,相違点を見つめなおし検証していく古くて新しい研究を続けることで,ガングリオシド機能の本質がみえてくるものと思われる.
このC2C12の系では,分化に伴ってGM3のシアル酸部分,セラミドのアシル鎖部分の微細構造変化が同時に起こるユニークな現象を見いだした.筋ジストロフィーのモデルマウスにおいて,ヒト(Neu5Ac)とマウス(Neu5Gc)のシアル酸構造の違いによって,症状の重症度が異なることも示唆されている40).また,近年,ガングリオシドのセラミド部分のアシル鎖構造の多様性に注目が集まりつつあり,我々のグループもこのC2C12の系以外にメタボリックシンドロームの病態にこのアシル鎖構造が重要な鍵になっていることを示唆している41).
シアル酸構造,アシル鎖構造を含めたガングリオシド詳細構造とその機能に注目することでスフィンゴ糖脂質の新たなフィールドの開拓が進むかもしれない.
上述のように,近年のシークエンス技術の進歩によって,これまで見つからなかったスフィンゴ糖脂質の生合成酵素の変異による疾患が新たに見つかってきた.もちろん,その疾患の発見,症状の解析だけですべてがわかるわけではない.GM3合成酵素欠損マウスおよびヒト欠損症で見いだされた聴覚機能障害はGM3の新たな機能を明示するものであるが,その詳細な分子機構は未知のままである.ヒト疾患やある一つの遺伝子改変マウスの単純な表現型解析だけでは,ガングリオシドの本質を見いだすことはできない.ガングリオシド合成酵素遺伝子変異によって,どのガングリオシドが消失し,どのスフィンゴ糖脂質が出現・増加したか,やはり詳細な脂質解析が重要な鍵である.どのようなガングリオシド(スフィンゴ糖脂質)の組成の場合にどこで何が起こるか,という地道な知識の積み重ねが必要になってくると考える.ヒトにおけるスフィンゴ糖脂質の生合成酵素の変異の症例に加え,これまで蓄積されたスフィンゴ糖脂質生合成酵素欠損マウスの知見,各種培養細胞モデルを用いた膨大な知見を統合していくことで,新たなスフィンゴ糖脂質の機能の本質が見いだされると思われる.
各スフィンゴ糖脂質の機能解明には細胞膜機能性微小領域(ラフト)の実態解明が切り離せない問題である.近年,高感度のイメージング用プローブおよび技術の開発も進み,生細胞上でスフィンゴ糖脂質が膜タンパク質と相互作用する様子を観察することも可能になってきた42, 43).従来の手法を用いた知見と新たな技術による知見とを組み合わせ,これまでのラフト像もブラッシュアップしていく必要がある.また,近年注目されるエキソソームをはじめとするマイクロベシクル上のスフィンゴ糖脂質を介した細胞間情報交換も想定されてきている.また,筋分化過程で見いだされたGM3のシアル酸分子種およびセラミドのアシル鎖分子種の構造変化は,同一スフィンゴ糖脂質分子種の微細構造変化による生物機能制御を示唆する新たな知見である.こういった点に注目した研究の進展によって予想もしなかったスフィンゴ糖脂質機能の本質がみえてくると思われる.そのためには今まで以上に農学,理学,医学,工学,薬学などさまざまな分野との交流と技術・情報交換が必須である.これまでの知見を大事にし,新たな視点・技術を用いてチャレンジを続け,新たなスフィンゴ糖脂質研究が展開されることを期待する.
謝辞Acknowledgments
本稿作成に記載されている我々の研究内容は,私立大学戦略的研究基盤形成支援事業「生体膜糖鎖異常に起因する生活習慣病発症機序の解明と臨床への応用」,新学術領域研究「統合的神経機能の制御を標的とした糖鎖の作動原理解明」の支援を受けて,主に東北医科薬科大学分子生体膜研究所で行われたものです.記載した聴覚に関する研究は吉川弥里先生(現・就実大学薬学部),筋分化研究に関しては郷詩織さん(現・名古屋大学大学院生命農学研究科博士後期課程)が中心になって行った仕事です.また,名古屋大学生物機能開発利用研究センター北島健先生にご指導・ご助言を賜りました.皆様に感謝申し上げます.
引用文献References
1) Jennemann, R. & Gröne, H.J. (2013) Prog. Lipid Res., 52, 231–248.
2) Russo, D., Parashuraman, S., & D’Angelo, G. (2016) Int. J. Mol. Sci., 17, E1732.
3) Kurzchalia, T.V. & Parton, R.G. (1999) Curr. Opin. Cell Biol., 11, 424–431.
4) Inokuchi, J. (2011) Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci., 87, 179–198.
5) Ishii, A., Ohta, M., Watanabe, Y., Matsuda, K., Ishiyama, K., Sakoe, K., Nakamura, M., Inokuchi, J., Sanai, Y., & Saito, M. (1998) J. Biol. Chem., 273, 31652–31655.
6) Inokuchi, J. & Kabayama, K. (2008) Trends Glycosci. Glycotechnol., 20, 353–371.
7) Yu, R.K., Tsai, Y.T., & Ariga, T. (2012) Neurochem. Res., 37, 1230–1244.
8) Schnaar, R.L., Gerardy-Schahn, R., & Hildebrandt, H. (2014) Physiol. Rev., 94, 461–518.
9) Nagata, Y., Yamashiro, S., Yodoi, J., Lloyd, K.O., Shiku, H., & Furukawa, K. (1992) J. Biol. Chem., 267, 12082–12089.
10) Haraguchi, M., Yamashiro, S., Yamamoto, A., Furukawa, K., Takamiya, K., Lloyd, K.O., Shiku, H., & Furukawa, K. (1994) Proc. Natl. Acad. Sci. USA, 91, 10455–10459.
11) Fukumoto, S., Miyazaki, H., Urano, T., Furukawa, K., & Furukawa, K. (1999) J. Biol. Chem., 274, 9271–9276.
12) Miyazaki, H., Fukumoto, S., Okada, M., Hasegawa, T., Furukawa, K., & Furukawa, K. (1997) J. Biol. Chem., 272, 24794–24799.
13) Kojima, Y., Fukumoto, S., Furukawa, K., Okajima, T., Wiels, J., Yokoyama, K., Suzuki, Y., Ohta, M., & Furukawa, K. (2000) J. Biol. Chem., 275, 15152–15156.
14) Ichikawa, S., Ozawa, K., & Hirabayashi, Y. (1998) Biochem. Biophys. Res. Commun., 253, 707–711.
15) Yamashita, T., Wada, R., Sasaki, T., Deng, C., Bierfreund, U., Sandhoff, K., & Proia, R.L. (1999) Proc. Natl. Acad. Sci. USA, 96, 9142–9147.
16) Kumagai, T., Tanaka, M., Yokoyama, M., Sato, T., Shinkai, T., & Furukawa, K. (2009) Biochem. Biophys. Res. Commun., 379, 456–459.
17) Nishie, T., Hikimochi, Y., Zama, K., Fukusumi, Y., Ito, M., Yokoyama, H., Naruse, C., Ito, M., & Asano, M. (2010) Glycobiology, 20, 1311–1322.
18) Yamashita, T., Hashiramoto, A., Haluzik, M., Mizukami, H., Beck, S., Norton, A., Kono, M., Tsuji, S., Danlotti, J.L., Werth, N., Sandhoff, R., Sandhoff, K., & Proia, R.L. (2003) Proc. Natl. Acad. Sci. USA, 100, 3445–3449.
19) Yoshikawa, M., Go, S., Takasaki, K., Kakazu, Y., Ohashi, M., Nagafuku, M., Kabayama, K., Sekimoto, J., Suzuki, S., Takaiwa, K., Kimitsuki, T., Matsumoto, N., Komune, S., Kamei, D., Saito, M., Fujiwara, M., Iwasaki, K., & Inokuchi, J. (2009) Proc. Natl. Acad. Sci. USA, 106, 9483–9488.
20) Niimi, K., Nishioka, C., Miyamoto, T., Takahashi, E., Miyoshi, I., Itakura, C., & Yamashita, T. (2011) Biochem. Biophys. Res. Commun., 406, 524–528.
21) Furukawa, K., Takamiya, K., Okada, M., Inoue, M., Fukumoto, S., & Furukawa, K. (2001) Biochim. Biophys. Acta, 1525, 1–12.
22) Klenk, E., Vater, W., & Bartsch, G. (1957) J. Neurochem., 1, 203–206.
23) Sandhoff, K. & Harzer, K. (2013) J. Neurosci., 33, 10195–10208.
24) Simpson, M.A., Cross, H., Proukakis, C., Priestman, D.A., Neville, D.C., Reinkensmeier, G., Wang, H., Wiznitzer, M., Gurtz, K., Verganelaki, A., Pryde, A., Patton, M.A., Dwek, R.A., Butters, T.D., Platt, F.M., & Crosby, A.H. (2004) Nat. Genet., 36, 1225–1229.
25) Fragaki, K., Ait-El-Mkadem, S., Chaussenot, A., Gire, C., Mengual, R., Bonesso, L., Beneteau, M., Ricci, J.E., Desquiret-Dumas, V., Procaccio, V., Rötig, A., & Paquis-Flucklinger, V. (2013) Eur. J. Hum. Genet., 21, 528–534.
26) Farukhi, F., Dakkouri, C., Wang, H., Wiztnitzer, M., & Traboulsi, E.I. (2006) Ophthalmic Genet., 27, 89–91.
27) Wang, H., Bright, A., Xin, B., Bockoven, J.R., & Paller, A.S. (2013) Am. J. Med. Genet. A, 161, 875–879.
28) Wang, H., Wang, A., Wang, D., Bright, A., Sency, V., Zhou, A., & Xin, B. (2016) Clin. Genet., 89, 625–629.
29) Boccuto, L., Aoki, K., Flanagan-Steet, H., Chen, C.F., Fan, X., Bartel, F., Petukh, M., Pittman, A., Saul, R., Chaubey, A., Alexov, E., Tiemeyer, M., Steet, R., & Schwartz, C.E. (2014) Hum. Mol. Genet., 23, 418–433.
30) Lee, J.S., Yoo, Y., Lim, B.C., Kim, K.J., Song, J., Choi, M., & Chae, J.H. (2016) Am. J. Med. Genet. A, 170, 2200–2205.
31) Harlalka, G.V., Lehman, A., Chioza, B., Baple, E.L., Maroofian, R., Cross, H., Sreekantan-Nair, A., Priestman, D.A., Al-Turki, S., McEntagart, M.E., Proukakis, C., Royle, L., Kozak, R.P., Bastaki, L., Patton, M., Wagner, K., Coblentz, R., Price, J., Mezei, M., Schlade-Bartusiak, K., Platt, F.M., Hurles, M.E., & Crosby, A.H. (2013) Brain, 136, 3618–3624.
32) Liu, Y., Su, Y., Wiznitzer, M., Epifano, O., & Ladisch, S. (2008) Glycobiology, 18, 593–601.
33) Yoshikawa, M., Go, S., Suzuki, S., Suzuki, A., Katori, Y., Morlet, T., Gottlieb, S.M., Fujiwara, M., Iwasaki, K., Strauss, K.A., & Inokuchi, J. (2015) Hum. Mol. Genet., 24, 2796–2807.
34) 井ノ口仁一(2015)生化学 87, 560–572.
35) Tagami, S., Inokuchi, J., Kabayama, K., Yoshimura, H., Kitamura, F., Uemura, S., Ogawa, C., Ishii, A., Saito, M., Ohtsuka, Y., Sakaue, S., & Igarashi, Y. (2002) J. Biol. Chem., 277, 3085–3092.
36) Kabayama, K., Sato, T., Kitamura, F., Uemura, S., Kang, B.W., Igarashi, Y., & Inokuchi, J. (2005) Glycobiology, 15, 21–29.
37) Kabayama, K., Sato, T., Saito, K., Loberto, N., Prinetti, A., Sonnino, S., Kinjo, M., Igarashi, Y., & Inokuchi, J. (2007) Proc. Natl. Acad. Sci. USA, 104, 13678–13683.
38) Nagafuku, M., Okuyama, K., Onimaru, Y., Suzuki, A., Odagiri, Y., Yamashita, T., Iwasaki, K., Fujiwara, M., Takayanagi, M., Ohno, I., & Inokuchi, J. (2012) Proc. Natl. Acad. Sci. USA, 109, 336–342.
39) Go, S., Go, S., Veillon, L., Ciampa, M.G., Mauri, L., Sato, C., Kitajima, K., Prinetti, A., Sonnino, S., & Inokuchi, J. (2017) J. Biol. Chem., 292, 7040–7051.
40) Martin, P.T., Camboni, M., Xu, R., Golden, B., Chandrasekharan, K., Wang, C.M., Varki, A., & Janssen, P.M. (2013) Glycobiology, 23, 833–843.
41) Veillon, L., Go, S., Matsuyama, W., Suzuki, A., Nagasaki, M., Yatomi, Y., & Inokuchi, J. (2015) PLoS One, 10, e0129645.
42) Suzuki, K.G., Kasai, R.S., Fujiwara, T.K., & Kusumi, A. (2013) Methods Cell Biol., 117, 373–390.
43) Suzuki, K.G., Kasai, R.S., Hirosawa, K.M., Nemoto, Y.L., Ishibashi, M., Miwa, Y., Fujiwara, T.K., & Kusumi, A. (2012) Nat. Chem. Biol., 8, 774–783.
著者紹介Author Profile
 郷 慎司(ごう しんじ)
郷 慎司(ごう しんじ)川崎医科大学病態代謝学講師.博士(農学).
略歴岐阜県生まれ.名古屋大学農学部卒業.同大学院生命農学研究科博士課程修了.東北薬科大学(現・東北医科薬科大学)分子生体膜研究所学術フロンティア研究員,助教を経て,2017年より現職.
研究テーマと抱負糖鎖の代謝制御機構と機能の解明.特に糖ヌクレオチドとシアル酸代謝に注目した研究.
ウェブサイトhttps://www.kawasaki-m.ac.jp/med/study/info.php?id=211
趣味HPLC.
 井ノ口 仁一(いのくち じんいち)
井ノ口 仁一(いのくち じんいち)東北医科薬科大学分子生体膜研究所所長.薬学部機能病態分子学教室教授.薬学博士.
略歴福岡県に生まれる.福岡大学薬学部を卒業.同大学院,生化学教室助手を経て,1985年ミシガン大学医学部神経化学研究所博士研究員.91年生化学工業東京研究所主任研究員を経て,98年北海道大学大学院薬学研究科助教授.2006年より現職.
研究テーマと抱負生体恒常性維持機構におけるスフィンゴ糖脂質の分子種特異的な作動原理を解明し,生理活性糖脂質としての位置付けを明確にすることが,使命であると考えている.
ウェブサイトhttp://www.tohoku-mpu.ac.jp/pharmacy/about/lp_d04/
趣味音楽鑑賞,ウォーキング,ガーデニング.