ヒトパラインフルエンザウイルス(hPIV)は,モノネガウイルス目のパラミクソウイルス科パラミクソウイルス亜科に属しており,パラミクソ亜科はさらにレスピロウイルス,モルビリウイルス,ルブラウイルス,アブラウイルス,へニパウイルスの五つの属に分類される.hPIVは1型から4型の血清型が知られており,hPIVのうち1型(hPIV1)と3型(hPIV3)は,マウスやラットに感染し肺炎を引き起こすセンダイウイルス(SeV)とともにレスピロウイルス属に,2型(hPIV2)と4型(hPIV4)は,おたふくかぜ(流行性耳下腺炎)の原因ウイルスであるムンプスウイルとともにルブラウイルス属に分類される1).
hPIVはかぜ症候群の15~20%を占めている病原体である2, 3).成人では通常軽い上気道炎の原因となるにすぎないが,乳幼児の初期感染や高齢者など免疫力が低下した人では,下部気道も侵され,しばしば重篤な症状を引き起こす.1歳未満の小児では,hPIV1とhPIV2により主に咽頭炎やクループ(喉頭気管支炎)を,hPIV3により気管支炎,細気管支炎あるいは肺炎を発症する4).hPIV1は2年ごとの秋に,hPIV3は毎年の春から初夏にかけて発生しているが,hPIVに対する有効なワクチンや抗ウイルス薬は開発されてない5–9).
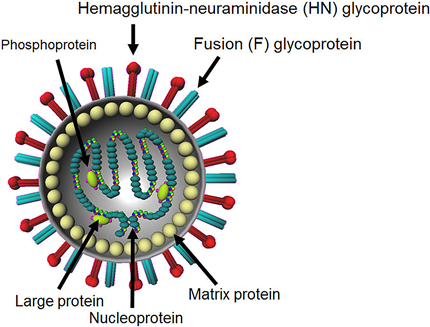
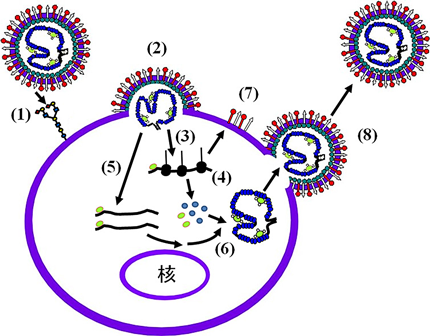
hPIVはマイナス一本鎖RNAウイルスで,ウイルスエンベロープ膜表面には赤血球凝集とノイラミニダーゼの活性を持つhemagglutinin-neuraminidase(HN)糖タンパク質と細胞融合活性を持つfusion(F)糖タンパク質がスパイク状に多数突出している(図1).これら二つの糖タンパク質の機能により宿主細胞に感染する.HN糖タンパク質は,細胞表面のシアル酸を含む糖タンパク質や糖脂質(ガングリオシド)への結合と,新生ウイルスの細胞からの遊離に関与する.F糖タンパク質は,ウイルスの侵入過程において,HN糖タンパク質と相互作用することで,ウイルス膜と宿主細胞膜を融合させ,リボ核タンパク質複合体の放出を誘導する(図2)10–13).本稿では,ヒトパラインフルエンザウイルスの感染性に関与する糖鎖について解説する.
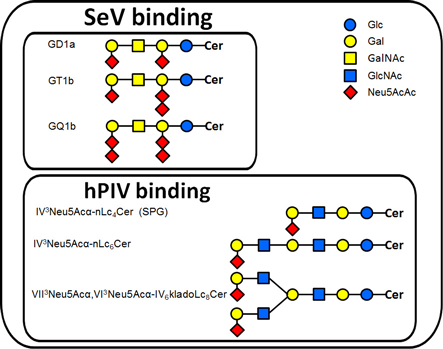
筆者らは,糖鎖構造の異なる多様な糖脂質(ガングリオシド)を用いて,hPIV1, hPIV3およびSeVの3種類のレスピロウイルス間で結合性を比較した.その結果,1)hPIV1とhPIV3はSeVと異なり,シアル酸を非還元末端に持つガングリオ系列の糖脂質には結合性を示さず,ネオラクト系列の糖脂質のみに結合した.2)hPIV1はシアル酸とガラクトースがα2,3結合(α2,3型シアル酸結合)したネオラクト系列の糖脂質のみに結合し,hPIV3はα2,3型シアル酸結合だけでなく,シアル酸とガラクトースがα2,6結合(α2,6型シアル酸結合)したネオラクト系列の糖脂質にも結合した.3)hPIV1とhPIV3はI血液型抗原性を示すlactoIV6kladooctaose構造を有する糖脂質へ強い結合性を示した.さらに3種類のレスピロウイルスによるヒト,モルモット,ウシ,ウマ赤血球の凝集性とI血液型糖鎖抗原を認識するヒト抗I血清,Galβ1-4GlcNAcあるいはGalβ1-3GalNAc構造を認識するRicinus communis agglutinin(RCA)レクチン,Galβ1-4GlcNAcβ1-3Gal構造を認識する単クローン抗体(H-11)を用いたシアリダーゼ処理前後の赤血球における糖鎖の解析から,4)hPIV1とhPIV3はヒトI血液型抗原となる分枝型ポリラクトサミン構造を有するシアロ糖鎖に高い結合性を示すことを見いだした(図3)14).一方,他のグループによりglycoarrayを用いたhPIV1とhPIV3の糖鎖結合性が報告された.hPIV1とhPIV3は,筆者らの報告と同様にα2,3型を非還元末端に持つラクトサミン構造の糖鎖に強い結合性を示すことが確認された.一方,いずれのウイルスもα2,6型糖鎖には結合性を示さなかった15–17).後述したように,シアル酸の結合様式を人工的に改変したヒト赤血球(hRBC)や哺乳動物細胞を用いたウイルスの吸着や感染性の結果から,hPIV3がα2,6型糖鎖にも結合性を有することが判明した.glycoarrayによる解析では,Alexa Fluor 488をN-ヒドロキシスクシンイミドエステルで蛍光標識化したウイルスを用いて糖鎖結合性を解析しているため,蛍光標識化がウイルスの結合性に影響しているものと推測される.
2種類のシアリダーゼ(sialidase from Arthrobacter ureafaciens: AUSD, α2,3-sialidase from Salmonella typhimurium LT2:23SD)と4種類のシアル酸転移酵素(α2,3-sialyltransferase from Photobacterium phosphoreum: ST3, α2,6-sialyltransferase from Photobacterium damselae: ST6, α2,3-(N)-sialyltransferase ST3Gal-III:ST3N, α2,6-(N)-sialyltransferase ST6Gal-I:ST6N)を用いて,糖鎖に付加したシアル酸の結合様式を人工的に改変したhRBCや哺乳動物細胞(LLC-MK2細胞,A549細胞,Lec2細胞)を作製し,hPIV1とhPIV3の細胞への吸着性と感染性を調べた.
hRBC膜にはα2,3型およびα2,6型シアル酸が豊富に存在する18–20).AUSD処理により末端シアル酸を除去するとhPIV1およびhPIV3の赤血球凝集活性が消失した.一方,23SD処理によりα2,3型シアル酸のみを除去すると,hPIV1の赤血球凝集活性は完全に消失したが,hPIV3の赤血球凝集活性は維持された.そこで,AUSD処理により末端シアル酸を除去後,糖タンパク質および糖脂質上のガラクトース残基にシアル酸を転移させる広い基質特異性を有するPhotobacterium由来のST3とST621–23)を用いてシアル酸を付加すると,hPIV1はST3処理hRBCのみに赤血球凝集活性を示し,hPIV3はST3処理hRBCおよびST6処理hRBCの両方に赤血球凝集活性を示した.また,N-結合型糖鎖特異的な哺乳動物由来ST3NあるいはST6Nで処理したhRBCでも同様であった.そのため,hPIV1はhRBC上のα2,3型シアル酸のみに結合し,hPIV3はα2,3型だけでなくα2,6型シアル酸にも結合できることが示された(表1).
hPIVはウイルス膜上のHN糖タンパク質を介してシアル酸に結合する.COS-7細胞上に発現させたHN1およびHN3糖タンパク質に対し,非還元末端のシアル酸とガラクトースの結合を改変したhRBCの赤血球吸着活性を調べた結果,ウイルス粒子の赤血球凝集活性と同様に,HN1糖タンパク質はα2,3型シアル酸で修飾されたhRBCのみを吸着し,HN3糖タンパク質はα2,3型に加えα2,6型シアル酸で修飾されたhRBCも吸着することが示された.一方,もう一つのウイルス膜スパイクタンパク質であるF糖タンパク質は,赤血球吸着活性を示さなかったことから,hPIVのシアル酸結合性はHN糖タンパク質のみに起因していることが確認された24).
23SD処理した哺乳動物細胞(サル腎臓由来LLC-MK2細胞とヒト肺胞基底上皮腺がん由来A549細胞)を用いてhPIV1とhPIV3の感染性を比較した.23SDでLLC-MK2細胞を処理し,α2,3型シアル酸を特異的に除去すると,hPIV1の感染性は23SDの濃度依存的に減少した.一方,hPIV3の感染性はほとんど減少しなかった.またA549細胞においても同様の結果を示した.そこで,シアリダーゼで処理したLLC-MK2細胞上の末端シアル酸とガラクトースの結合様式をレクチンの結合性により解析した.23SD処理後のLLC-MK2細胞に2,3型シアル酸を認識するMAAはほとんど結合しなかったが,α2,6型シアル酸を認識するSNAは結合した.またAUSD処理後のLLC-MK2細胞には,MAAおよびSNAのどちらもほとんど結合せず,ウイルスの感染性も著しく低下した.これにより,hPIV3は23SDで除去されなかったα2,6型シアル酸をウイルス感染における受容体として利用できることが示唆された.
表1 シアル酸結合様式の異なるヒト赤血球のhPIVによる凝集活性| hRBC | シアル酸の結合 | 赤血球凝集活性 |
|---|
| α2,3 | α2,6 | hPIV1 | hPIV3 |
|---|
| Native-hRBCs | ○ | ○ | 128 | 128 |
| AUSD-hRBCs | × | × | <2 | <2 |
| 23SD-hRBCs | × | ○ | <2 | 16 |
| ST3-hRBCs | ○ | × | 256 | 256 |
| ST6-hRBCs | × | ○ | <2 | 128 |
| ○:検出,×:不検出.数字は赤血球凝集活性を示す. |
次にシアル酸転移酵素を用いて再シアリル化した哺乳動物細胞へのhPIV1およびhPIV3の感染性を評価した.A549細胞をST3あるいはST6で処理し,hPIV1とhPIV3の感染性を調べた.正常な哺乳動物細胞は細胞表面に多数のシアル酸を持つため,細胞内シアル酸転移酵素を阻害するST-I25)でA549細胞を処理し,さらにAUSDで表面シアル酸を除去後,ST3あるいはST6を用いてA549細胞を再シアリル化した.A549細胞に対するST3処理はhPIV1およびhPIV3の感染性を増加させた.一方,ST6処理はhPIV1の感染性に影響を与えなかったが,hPIV3の感染性を優位に増加させた.このため,hPIV1とhPIV3はA549細胞表面上のα2,3型シアル酸を受容体として感染すること,hPIV3はα2,3型シアル酸だけでなくα2,6型シアル酸も受容体として認識できることが示唆された24).
Lec2細胞はCHO細胞由来Pro-5細胞を親株とする変異細胞株で,ゴルジ体におけるCMP-シアル酸トランスポーターが変異しているために細胞表面上のシアル酸残基を欠如している.Lec2細胞をA549細胞と同様にST3あるいはST6を用いて再シアリル化処理を行い,hPIV1とhPIV3の感染性を調べた結果,未処理のLec2細胞にはhPIV1とhPIV3のどちらも感染しなかったが,ST3処理により再シアリル化したLec2細胞は両ウイルスの感染性を獲得した.一方,ST6処理したLec2細胞にはいずれのウイルスもほとんど感染性を示さなかった.そこで,再シアリル化したLec2細胞へのhPIV3の結合性をFACSにより解析すると,hPIV3はST3処理したLec2細胞へ結合したのに対し,酵素未処理Lec2細胞およびST6処理Lec2細胞へは結合しなかった.ST6処理Lec2細胞へのSNAレクチンの結合性は認められたことから,hPIV3はhRBCやA549細胞上のα2,6型シアル酸含有糖鎖に結合性を示したが,Lec2細胞上のα2,6型シアル酸含有糖鎖を認識できないことが判明した.この結果は,hPIVの吸着に非還元末端シアル酸の結合様式だけでなく,内部糖鎖の構造が重要であることを示唆している.
4. α2,6型シアル酸への結合性を規定するアミノ酸残基
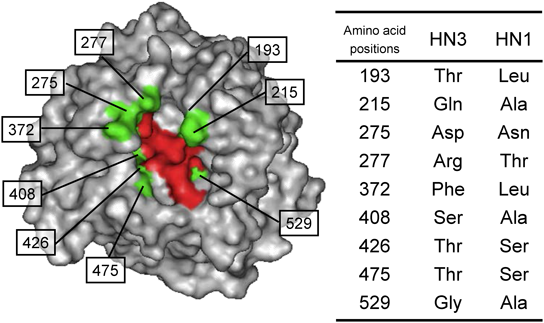
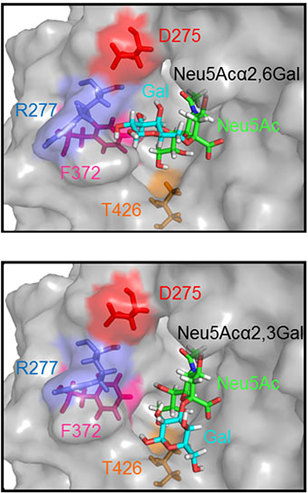
HN1糖タンパク質とHN3糖タンパク質のアミノ酸配列を比較し,HN3糖タンパク質のアミノ酸配列においてHN1糖タンパク質と異なるアミノ酸残基を選出した.さらに,タンパク質三次元構造表示ソフトPymolを用いて,選出した各アミノ酸残基のうち,HN3糖タンパク質のシアル酸結合ポケット近傍に位置するアミノ酸残基を解析した.シアル酸と直接水素結合するHN3糖タンパク質の8か所のアミノ酸残基(192, 276, 337, 409, 424, 502, 530および549)はHN1糖タンパク質と同一だったが,その近傍に位置する9か所のアミノ酸残基(193, 215, 275, 277, 372, 408, 426, 475および529)はHN1糖タンパク質と異なっていた(図4).そこで,HN3糖タンパク質の遺伝子にHN1糖タンパク質の遺伝子に相当する1あるいは2アミノ酸置換(T193L, Q215A, D275N/R277T, F372L, S408A, T426S, T475SおよびG529A)を導入した8種類の真核細胞発現プラスミドを構築し,これらの変異導入HN3糖タンパク質をCOS-7細胞上に発現させた.Q215A, S408AおよびT475Sのアミノ酸置換では,細胞表面上のHN3糖タンパク質発現量が野生型と比較して50%程度まで減少し,未処理hRBCに対する赤血球吸着活性も40%以下まで低下した.さらに,G529Aのアミノ酸置換では,細胞表面発現量はほとんど減少しなかったが,赤血球吸着活性は50%程度まで減少し,シアル酸結合親和性の低下が推測された.これらのアミノ酸置換では,細胞膜上へのタンパク質の移行性や膜上でのタンパク質の構造安定性が損なわれたことが示唆された.一方,T193, D275N/R277T, F372LおよびT426Sのアミノ酸置換では,発現量の低下は認められず,野生型と同程度の細胞膜上への移行性や構造安定性,赤血球吸着活性を保持していることが判明した.さらに,変異型HN3糖タンパク質のシアリダーゼ活性を比較解析した結果,細胞表面発現量および赤血球吸着活性が減少したQ215A, S408A, T475SおよびG529Aのアミノ酸置換では,シアリダーゼ活性が野生型HN3糖タンパク質の30%以下まで減少した.F372Lのアミノ酸置換ではシアリダーゼ活性が40%程度まで低下した.T193L, D275/R277TおよびT426Sのアミノ酸置換ではシアリダーゼ活性の減少は認められなかった.そこで,細胞表面発現量および未処理hRBCに対する赤血球吸着活性が減少しなかった変異型HN3糖タンパク質の23SD処理hRBCに対する赤血球吸着活性を比較した.T193Lのアミノ酸置換は23SD処理hRBCに対し野生型と同程度の吸着活性を示した.一方,D275N/R277TおよびT426Sのアミノ酸置換は,野生型に比べて23SD処理hRBCに対する吸着活性が減少し,F372Lの置換は23SD-hRBCに対する吸着活性がHN1糖タンパク質と同程度まで顕著に減少した.次に,α2,6型シアル酸残基で再シアリル化したST6処理hRBCに対する変異型HN3糖タンパク質の赤血球吸着活性を比較した.未処理hRBCに対する赤血球吸着活性が減少しなかった変異導入HN3糖タンパク質のうち,T193Lのアミノ酸置換は,ST6処理hRBCに対し野生型HN3糖タンパク質と同程度の吸着活性を示した.一方,D275N/R277TおよびT426Sの置換は,ST6処理hRBCの吸着活性が大きく減少し,F372Lの置換はST6処理hRBCに吸着活性をほとんど示さなかった(図5).以上の結果より,HN3糖タンパク質のシアル酸結合ポケット近傍に位置するD275, R277, F372およびT426の四つのアミノ酸残基が,α2,6型シアル酸の認識性を規定していることが示唆された26).
シアル酸とガラクトースの結合において,α2,3結合ではシアル酸の六員環とガラクトースの六員環が一つの酸素原子を介して結合し,α2,6結合では一つの酸素原子と一つの炭素原子の二つの原子を介して結合している.このため,α2,3結合よりα2,6結合の方がシアル酸とガラクトースの距離が長く,ガラクトースがより離れた位置に異なる角度で存在する.そのため,α2,3型シアル酸とα2,6型シアル酸では,シアル酸とガラクトースの二糖の立体構造が大きく異なる.シアル酸とHN3糖タンパク質のアミノ酸残基との相互作用を明らかにするために,シアル酸とガラクトースがα2,3結合またはα2,6結合した二糖とHN3糖タンパク質のドッキングシミュレーションを行った.その結果,α2,6結合したガラクトースは275, 277および372位のアミノ酸残基の近傍に位置することが推測された(図6).
hPIVは硫酸化糖脂質の一種であるスルファチドと結合性を示した.そこで,hPIVの感染過程におけるスルファチドの影響を調べた.その結果,1)hPIV3感染により引き起こされる多核巨細胞形成は,抗スルファチド単クローン抗体(GS5)で培養細胞を前処理することにより著しく増加した.2)スルファチドを欠損しているCOS-7細胞で観察される著しい多核巨細胞形成は,セレブロシドガラクトシルトランスフェラーゼ(CGT)とセレブロシドスルホトランスフェラーゼ(CST)の遺伝子導入によりスルファチドを発現させた細胞(SulCOS1)ではほとんど消失した.3)スルファチド発現細胞におけるhPIV-3の感染性は,親株細胞と比較して著しく低下した.4)hPIV3のHNおよびF糖タンパク質を発現させたCOS-7細胞で観察される多核巨細胞形成は,スルファチドを添加することで抑制された27).この結果は,hPIV3感染によるウイルス膜と細胞膜あるいは細胞膜と細胞膜の膜融合において,HN糖タンパク質とスルファチドが結合した場合,F糖タンパク質の構造変化を誘導する分子メカニズムが正常に機能しないことを示唆している.
すでに述べたように,hPIV3はヒトI血液型抗原となる分枝型ポリラクトサミン構造を有するシアロ糖鎖に高い結合性を示す.I血液型抗原糖鎖を発現していないCHO-K1細胞にβ1,6-(N)-アセチルグルコサミン転移酵素3(IGnT3)の遺伝子を導入したCHO-IGnT3細胞を作製し,hPIV3感染性を比較した.CHO-IGnT3ではI抗原糖鎖の発現量が増加し,CHO-K1細胞と比較して多核巨細胞形成が著しく促進された.一方,IGnT遺伝子をノックダウンしたHEp-2細胞では,I血液型抗原糖鎖の発現量は低下し,hPIV3感染による多核巨細胞形成は抑制された(論文投稿準備中).これらの成果は,hPIVの細胞融合過程においても糖鎖が機能することを示唆している.
遺伝子配列が報告されている98株のhPIV3についてHN3糖タンパク質のアミノ酸配列を比較したところ,D275, R277, F372およびT426のアミノ酸が置換されたhPIV3株は存在しなかった.このため,これらのアミノ酸残基はhPIV3の増殖性や宿主間伝播において必須なのかもしれない.すでに述べたように,hPIV1感染では主に上気道炎を発症し,hPIV3感染では下気道炎を発症する4).またhPIV3はhPIV1よりも重症化する傾向がある28).ヒト上気道にα2,6型シアル酸が豊富に存在することが知られている29)ことから,hPIV3がα2,6型シアル酸にも結合性を示すことが,hPIV1に比べて下気道炎を発症する要因であるかもしれない.hPIVが認識する詳細な糖鎖構造とヒト呼吸器に分布する糖鎖の解析によりhPIVの病毒性や組織指向性との関連性が明らかになると期待される.
謝辞Acknowledgments
本稿で紹介した研究の多くは,福島圭穣博士(現:徳島大学薬学部助教),高橋忠伸准教授とともに行ったものである.また,本研究に関わった多くの共同研究者に深くお礼申し上げます.
引用文献References
1) Henrickson, K.J. (2003) Clin. Microbiol. Rev., 16, 242–264.
2) Newman, J.T., Riggs, J.M., Surman, S.R., McAuliffe, J.M., Mulaikal, T.A., Collins, P.L., Murphy, B.R., & Skiadopoulos, M.H. (2004) J. Virol., 78, 2017–2028.
3) Sinaniotis, C.A. (2004) Paediatr. Respir. Rev., 5(Suppl A), S197–S200.
4) Weinberg, G.A., Hall, C.B., Iwane, M.K., Poehling, K.A., Edwards, K.M., Griffin, M.R., Staat, M.A., Curns, A.T., Erdman, D.D., & Szilagyi, P.G.; New Vaccine Surveillance Network. (2009) J. Pediatr., 154, 694–699.
5) Slobod, K.S., Shenep, J.L., Luján-Zilbermann, J., Allison, K., Brown, B., Scroggs, R.A., Portner, A., Coleclough, C., & Hurwitz, J.L. (2004) Vaccine, 22, 3182–3186.
6) Skiadopoulos, M.H., Tatem, J.M., Surman, S.R., Mitcho, Y., Wu, S.L., Elkins, W.R., & Murphy, B.R. (2002) Vaccine, 20, 1846–1852.
7) Zhan, X., Slobod, K.S., Krishnamurthy, S., Luque, L.E., Takimoto, T., Jones, B., Surman, S., Russell, C.J., Portner, A., & Hurwitz, J.L. (2008) Vaccine, 26, 3480–3488.
8) Jones, B., Zhan, X., Mishin, V., Slobod, K.S., Surman, S., Russell, C.J., Portner, A., & Hurwitz, J.L. (2009) Vaccine, 27, 1848–1857.
9) Bartlett, E.J., Cruz, A.M., Boonyaratanakornkit, J., Esker, J., Castaño, A., Skiadopoulos, M.H., Collins, P.L., Murphy, B.R., & Schmidt, A.C. (2010) Vaccine, 28, 767–779.
10) Chanock, R.M., Murphy, B.R., & Collins, P.L.(2001) in Fields Virology (Knipe, D.M., Howley, P.M., eds.), Vol.1, pp.1341-1380, Lippincott Williams & Wilkins, Pennsylvania.
11) Moscona, A. & Peluso, R.W. (1993) J. Virol., 67, 6463–6468.
12) Alymova, I.V., Taylor, G., Mishin, V.P., Watanabe, M., Murti, K.G., Boyd, K., Chand, P., Babu, Y.S., & Portner, A. (2008) J. Virol., 82, 8400–8410.
13) Lamb, R.A. (1993) Virology, 197, 1–11.
14) Suzuki, T., Portner, A., Scroggs, R.A., Uchikawa, M., Koyama, N., Matsuo, K., Suzuki, Y., & Takimoto, T. (2001) J. Virol., 75, 4604–4613.
15) Amonsen, M., Smith, D.F., & Air, G.M. (2007) J. Virol., 81, 8341–8345.
16) Tappert, M.M., Porterfield, J.Z., Mehta-D’Souza, P., Gulati, S., & Air, G.M. (2011) J. Virol., 85, 12146–12159.
17) Song, X., Yu, H., Chen, X., Lasanajak, Y., Tappert, M.M., Air, G.M., Tiwari, V.K., Cao, H., Chokhawala, H.A., Zheng, H., Cummings, R.D., & Smith, D.F. (2011) J. Biol. Chem., 286, 31610–31622.
18) Aminoff, D., Anderson, J., Dabich, L., & Gathmann, W.D. (1980) J.Hematol, 9, 381–389.
19) Bratosin, D., Mazurier, J., Debray, H., Lecocq, M., Boilly, B., Alonso, C., Moisei, M., Motas, C., & Montreuil, J. (1995) Glycoconj. J., 12, 258–267.
20) Bulai, T., Bratosin, D., Pons, A., Montreuil, J., & Zanetta, J.P. (2003) FEBS Lett., 534, 185–189.
21) Tsukamoto, H., Takakura, Y., & Yamamoto, T. (2007) J. Biol. Chem., 282, 29794–29802.
22) Yamamoto, T., Nakashizuka, M., & Terada, I. (1998) J. Biochem., 123, 94–100.
23) Yamamoto, T., Nakashizuka, M., Kodama, H., Kajihara, Y., & Terada, I. (1996) J. Biochem., 120, 104–110.
24) Fukushima, K., Takahashi, T., Ito, S., Takaguchi, M., Takano, M., Kurebayashi, Y., Oishi, K., Minami, A., Kato, T., Park, E.Y., Nishimura, H., Takimoto, T., & Suzuki, T. (2014) Virology, 464–465, 424–431.
25) Rillahan, C.D., Antonopoulos, A., Lefort, C.T., Sonon, R., Azadi, P., Ley, K., Dell, A., Haslam, S.M., & Paulson, J.C. (2012) Nat. Chem. Biol., 8, 661–668.
26) Fukushima, K., Takahashi, T., Ueyama, H., Takaguchi, M., Ito, S., Oishi, K., Minami, A., Ishitsubo, E., Tokiwa, H., Takimoto, T., & Suzuki, T. (2015) FEBS Lett., 589, 1278–1282.
27) Takahashi, T., Ito, K., Fukushima, K., Takaguchi, M., Hayakawa, T., Suzuki, Y., & Suzuki, T. (2012) J. Biochem., 152, 373–380.
28) Chanock, R. (2001) Clin. Microbiol. Rev., 16, 242–264.
29) Baum, L.G. & Paulson, J.C. (1990) Acta Histochem. Suppl., 40, 35–38.
著者紹介Author Profile
 鈴木 隆(すずき たかし)
鈴木 隆(すずき たかし)静岡県立大学薬学部薬学部薬学科(生化学分野)教授,薬学研究院(生化学教室)教授(兼務).薬学博士.
略歴1956年静岡県に生まる.79年静岡薬科大学卒業.84年同大学院博士課程修了.同年シノテスト研究所.91年静岡県立大学助手.94年静岡県立大学講師.96年静岡県立大学助教授.97~99年米国St. Jude Children's Research Hospital客員研究員.2006年より静岡県立大学教授.
研究テーマと抱負私たちは,糖鎖が関わるすべての生命現象に興味を持っています.特に,ウイルス感染症,中枢神経機能,癌における役割を分子レベル,遺伝子レベルで解明しています.さらに,その成果を応用することを目指しています.
ウェブサイトhttp://w3pharm.u-shizuoka-ken.ac.jp/~biochem/
趣味野菜栽培,釣り.