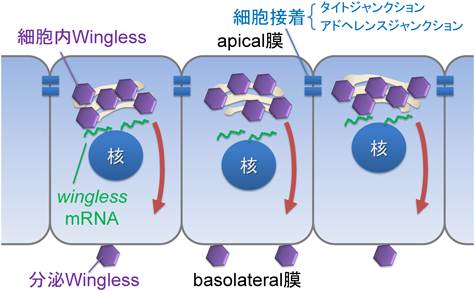
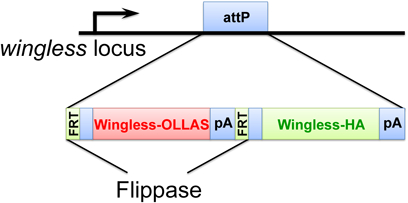
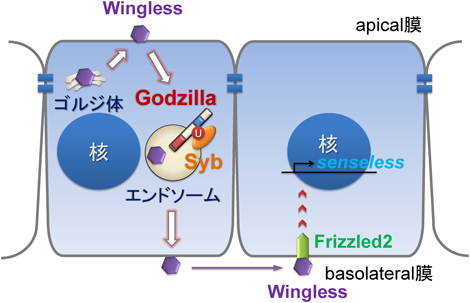
2) Yamazaki, Y., Palmer, L., Alexandre, C., Kakugawa, S., Beckett, K., Gaugue, I., Palmer, R.H., & Vincent, J.P. (2016) Nat. Cell Biol., 18, 451–457.
7) Yamazaki, Y., Schonherr, C., Varshney, G.K., Dogru, M., Hallberg, B., & Palmer, R.H. (2013) EMBO J., 32, 524–537.
9) Kakugawa, S., Langton, P.F., Zebisch, M., Howell, S.A., Chang, T.H., Liu, Y., Feizi, T., Bineva, G., O’Reilly, N., Snijders, A.P., Jones, E.Y., & Vincent, J.P. (2015) Nature, 519, 187–192.
10) Yamamoto, H., Awada, C., Hanaki, H., Sakane, H., Tsujimoto, I., Takahashi, Y., Takao, T., & Kikuchi, A. (2013) J. Cell Sci., 126, 2931–2943.
11) Farin, H.F., Jordens, I., Mosa, M.H., Basak, O., Korving, J., Tauriello, D.V., de Punder, K., Angers, S., Peters, P.J., Maurice, M.M., & Clevers, H. (2016) Nature, 530, 340–343.
12) Coombs, G.S., Yu, J., Canning, C.A., Veltri, C.A., Covey, T.M., Cheong, J.K., Utomo, V., Banerjee, N., Zhang, Z.H., Jadulco, R.C., Concepcion, G.P., Bugni, T.S., Harper, M.K., Mihalek, I., Jones, C.M., Ireland, C.M., & Virshup, D.M. (2010) J. Cell Sci., 123, 3357–3367.
14) Gross, J.C., Chaudhary, V., Bartscherer, K., & Boutros, M. (2012) Nat. Cell Biol., 14, 1036–1045.