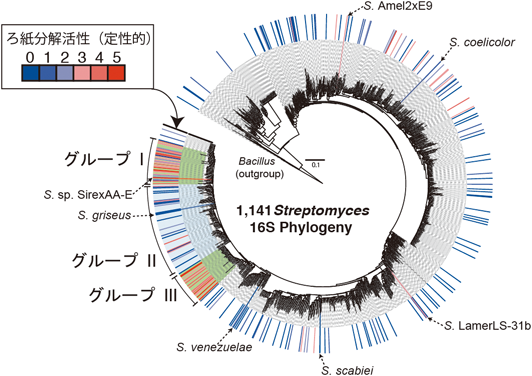
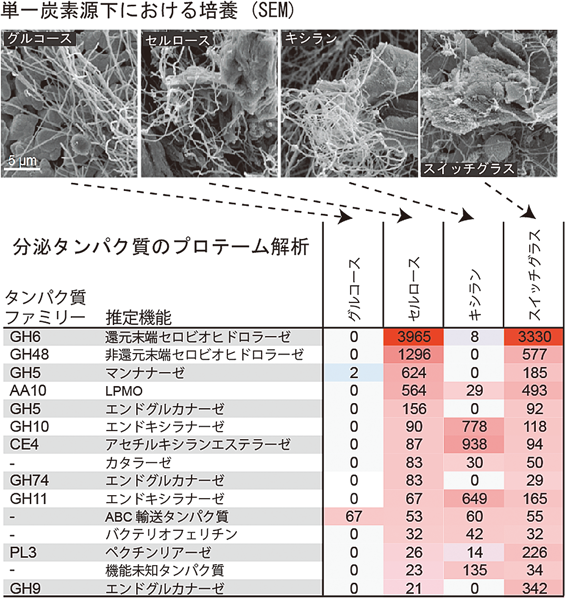
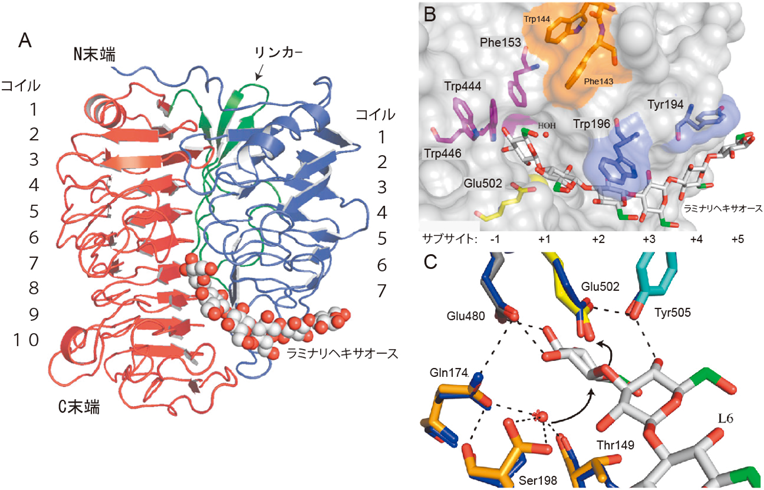
多糖類利用に向けたセルロース分解性昆虫共生細菌の発見およびそれらが産出する糖質分解酵素の機能・構造解析Discovery of the novel insect-symbiont cellulolytic microbes and biochemical analyses of their enzymes to enhance polysaccharide deconstruction technology
1 北海道大学国際食資源大学院Graduate School for Global Food Resources, Hokkaido University ◇ 〒060–8587 札幌市北区北9条西9丁目 ◇ Sapporo, West 9 North 9 Kita-ward, Sapporo city, Hokkaido 060–8587
2 北海道大学工学研究院Research Faculty of Engineering, Hokkaido University ◇ 〒060–8628 札幌市北区北13条西8丁目 ◇ Sapporo, West 8 North 13 Kita-ward, Sapporo city, Hokkaido 060–8628
3 北海道大学農学研究院Research Faculty of Agriculture, Hokkaido University ◇ 〒060–8587 札幌市北区北9条西9丁目 ◇ Sapporo, West 9 North 9 Kita-ward, Sapporo city, Hokkaido 060–8589
4 北海道大学国際連携研究教育局GI-CoREGlobal Institute for Collaborative Research and Education, Hokkaido University ◇ 〒060–0815 札幌市北区北15条西8丁目 ◇ Sapporo, West 8 North 15 Kita-ward, Sapporo city, 060–0815