5) Reiss, S., Rebhan, I., Backes, P., Romero-Brey, I., Erfle, H., Matula, P., Kaderali, L., Poenisch, M., Blankenburg, H., Hiet, M.S., Longerich, T., Diehl, S., Ramirez, F., Balla, T., Rohr, K., Kaul, A., Bühler, S., Pepperkok, R., Lengauer, T., Albrecht, M., Eils, R., Schirmacher, P., Lohmann, V., & Bartenschlager, R. (2011) Cell Host Microbe, 9, 32–45.
6) Hsu, N.-Y., Ilnytska, O., Belov, G., Santiana, M., Chen, Y.H., Takvorian, P.M., Pau, C., van der Schaar, H., Kaushik-Basu, N., Balla, T., Cameron, C.E., Ehrenfeld, E., van Kuppeveld, F.J., & Altan-Bonnet, N. (2010) Cell, 141, 799–811.
7) Amako, Y., Sarkeshik, A., Hotta, H., Yates, J. 3rd, & Siddiqui, A. (2009) J. Virol., 83, 9237–9246.
9) Wu, M.-J., Ke, P.-Y., Hsu, J.T.-A., Yeh, C.-T., & Horng, J.-T. (2014) Cell. Microbiol., 16, 1603–1618.
10) Tang, W.-F., Yang, S.Y., Wu, B.W., Jheng, J.R., Chen, Y.L., Shih, C.H., Lin, K.H., Lai, H.C., Tang, P., & Horng, J.T. (2007) J. Biol. Chem., 282, 5888–5898.
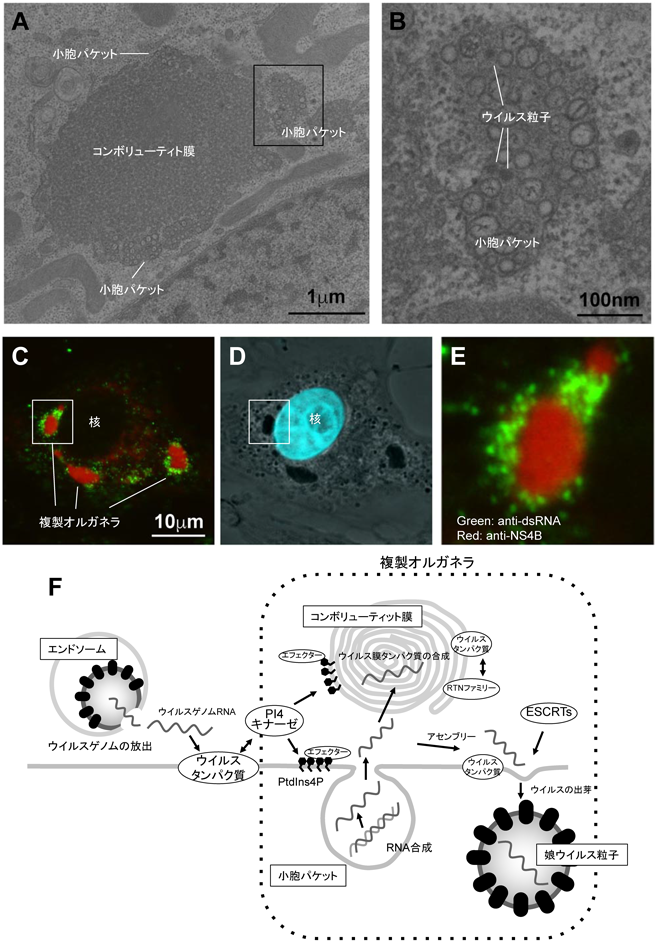
12) Tabata, K., Arimoto, M., Arakawa, M., Nara, A., Saito, K., Omori, H., Arai, A., Ishikawa, T., Konishi, E., Suzuki, R., Matsuura, Y., & Morita, E. (2016) Cell Reports, 16, 2339–2347.
15) Diaz, A., Zhang, J., Ollwerther, A., Wang, X., & Ahlquist, P. (2015) PLoS Pathog., 11, e1004742.