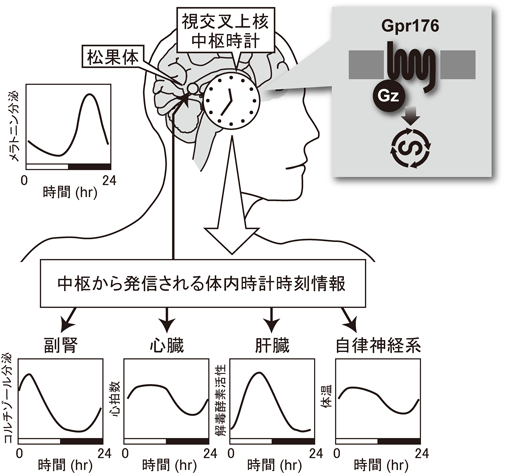
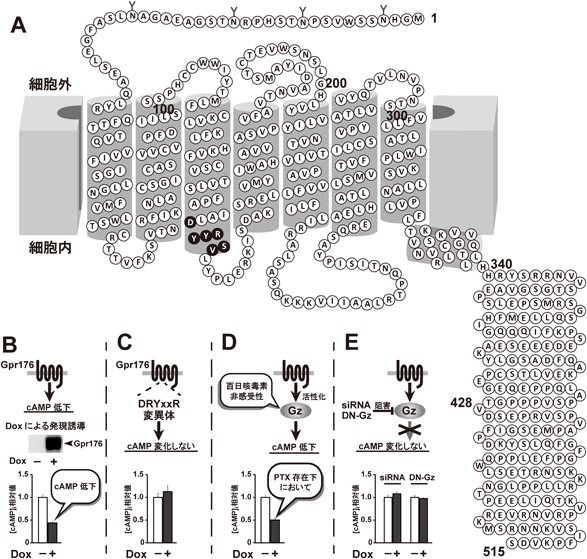
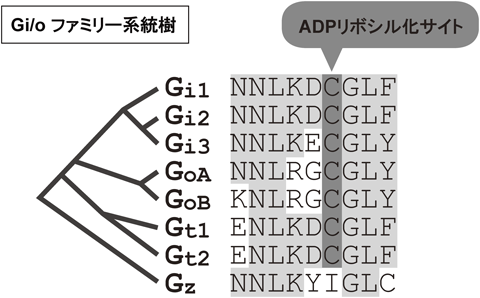
2) Doi, M., Murai, I., Kunisue, S., Setsu, G., Uchio, N., Tanaka, R., Kobayashi, S., Shimatani, H., Hayashi, H., Chao, H.W., Nakagawa, Y., Takahashi, Y., Hotta, Y., Yasunaga, J., Matsuoka, M., Hastings, M.H., Kiyonari, H., & Okamura, H. (2016) Nat. Commun., 7, 10583.
4) Doi, M., Takahashi, Y., Komatsu, R., Yamazaki, F., Yamada, H., Haraguchi, S., Emoto, N., Okuno, Y., Tsujimoto, G., Kanematsu, A., Ogawa, O., Todo, T., Tsutsui, K., van der Horst, G.T.J., & Okamura, H. (2010) Nat. Med., 16, 67–74.
5) Doi, M., Ishida, A., Miyake, A., Sato, M., Komatsu, R., Yamazaki, F., Kimura, I., Tsuchiya, S., Kori, H., Seo, K., Yamaguchi, Y., Matsuo, M., Fustin, J.-M., Tanaka, R., Santo, Y., Yamada, H., Takahashi, Y., Araki, M., Nakao, K., Aizawa, S., Kobayashi, M., Obrietan, K., Tsujimoto, G., & Okamura, H. (2011) Nat. Commun., 2, 327.
6) Yamaguchi, Y., Suzuki, T., Mizoro, Y., Kori, H., Okada, K., Chen, Y., Fustin, J.M., Yamazaki, F., Mizuguchi, N., Zhang, J., Dong, X., Tsujimoto, G., Okuno, Y., Doi, M., & Okamura, H. (2013) Science, 342, 85–90.
9) Fong, H.K., Yoshimoto, K.K., Eversole-Cire, P., & Simon, M.I. (1988) Proc. Natl. Acad. Sci. USA, 85, 3066–3070.
10) Matsuoka, M., Itoh, H., Kozasa, T., & Kaziro, Y. (1988) Proc. Natl. Acad. Sci. USA, 85, 5384–5388.
11) Berstein, G., Blank, J.L., Smrcka, A.V., Higashijima, T., Sternweis, P.C., Exton, J.H., & Ross, E.M. (1992) J. Biol. Chem., 267, 8081–8088.
12) Graziano, M.P., Freissmuth, M., & Gilman, A.G. (1989) J. Biol. Chem., 264, 409–418.
13) Linder, M.E., Ewald, D.A., Miller, R.J., & Gilman, A.G. (1990) J. Biol. Chem., 265, 8243–8251.
14) Singer, W.D., Miller, R.T., & Sternweis, P.C. (1994) J. Biol. Chem., 269, 19796–19802.
15) Casey, P.J., Fong, H.K., Simon, M.I., & Gilman, A.G. (1990) J. Biol. Chem., 265, 2383–2390.