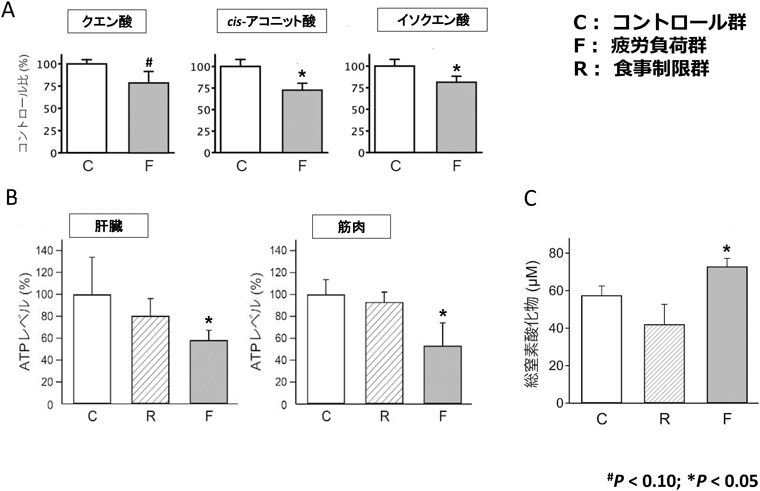
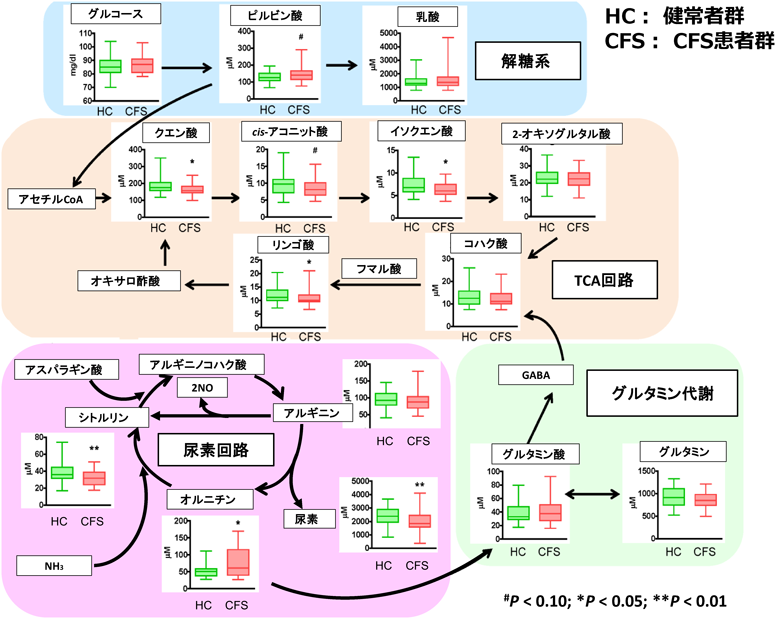
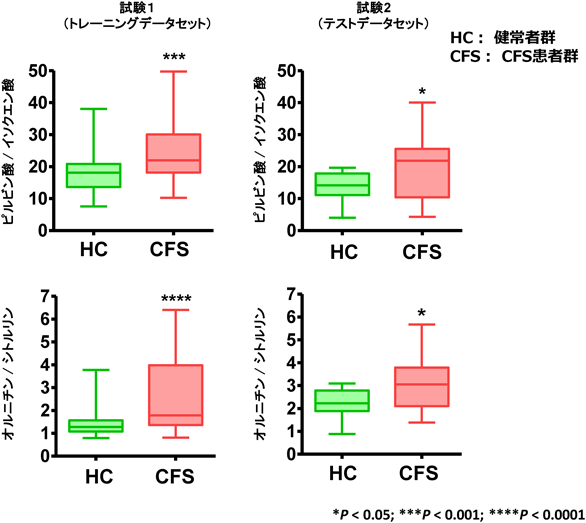
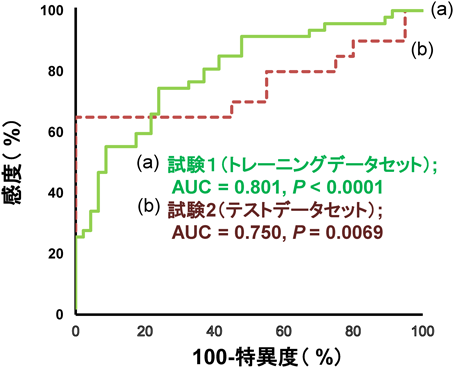
メタボローム解析を用いた慢性疲労症候群の診断バイオマーカーの開発Development of diagnostic biomarkers for chronic fatigue syndrome using metabolome analysis
1 理化学研究所科学技術ハブ推進本部健康生き活き羅針盤リサーチコンプレックス推進プログラム融合研究推進グループ新規計測開発チームHealth Metrics Development Team, RIKEN Compass to Healthy Life Research Complex Program ◇ 〒650–0047 神戸市中央区港島南町6–7–1 ◇ 6–7–1 Minatojima-minamimachi, Chuo-ku, Kobe, Hyogo 650–0047, Japan
2 大阪市立大学大学院医学研究科生理学第一Department of Physiology, Osaka City University Graduate School of Medicine ◇ 〒545–8585 大阪市阿倍野区旭町1–4–3 ◇ 1–4–3, Asahi-machi, Abeno-ku, Osaka, 545–8585, Japan
3 理化学研究所ライフサイエンス技術基盤研究センター生命機能動的イメージング部門細胞機能評価研究チームCellular Function Imaging Team, Division of Bio-function Dynamics Imaging, RIKEN Center for Life Science Technologies ◇ 〒650–0047 神戸市中央区港島南町6–7–3 ◇ 6–7–3 Minatojima-minamimachi, Chuo-ku, Kobe, Hyogo 650–0047, Japan
4 理化学研究所CLST-JEOL連携センターマルチモダル微細構造解析ユニットMulti-modal Microstructure Analysis Unit, RIKEN CLST-JEOL Collaboration Center ◇ 〒650–0047 神戸市中央区港島南町6–7–3 ◇ 6–7–3 Minatojima-minamimachi, Chuo-ku, Kobe, Hyogo 650–0047, Japan