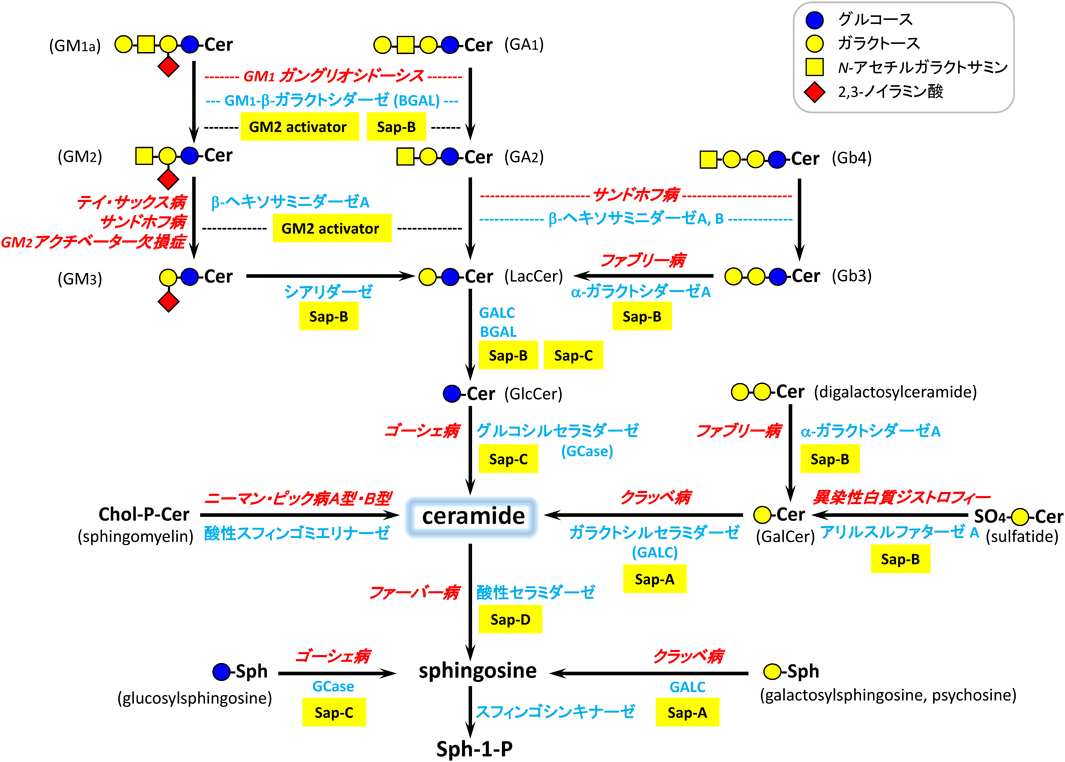
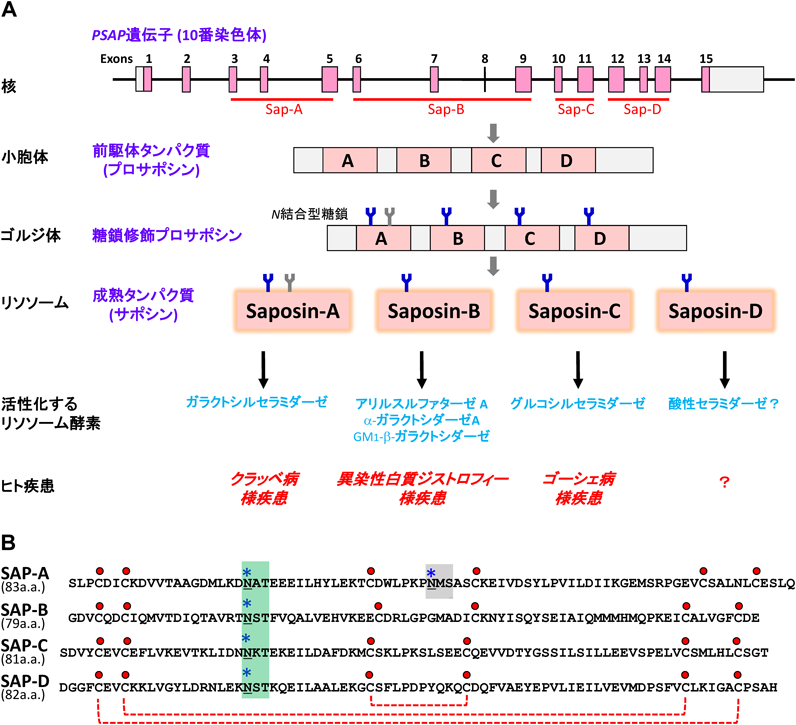
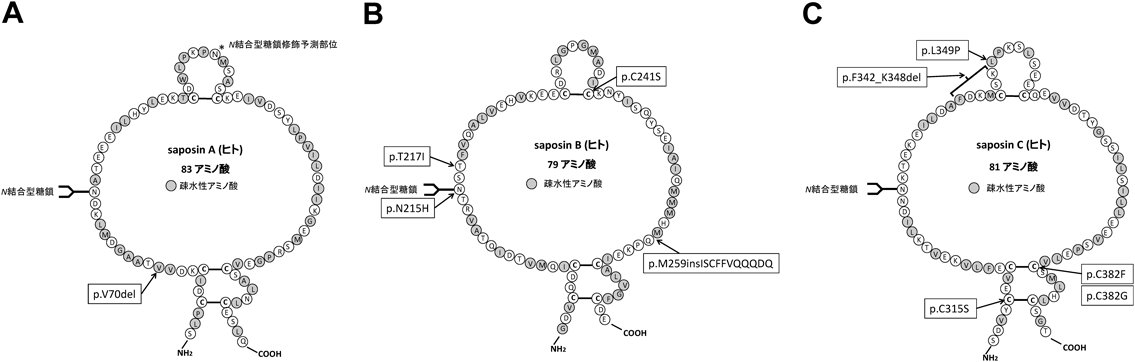
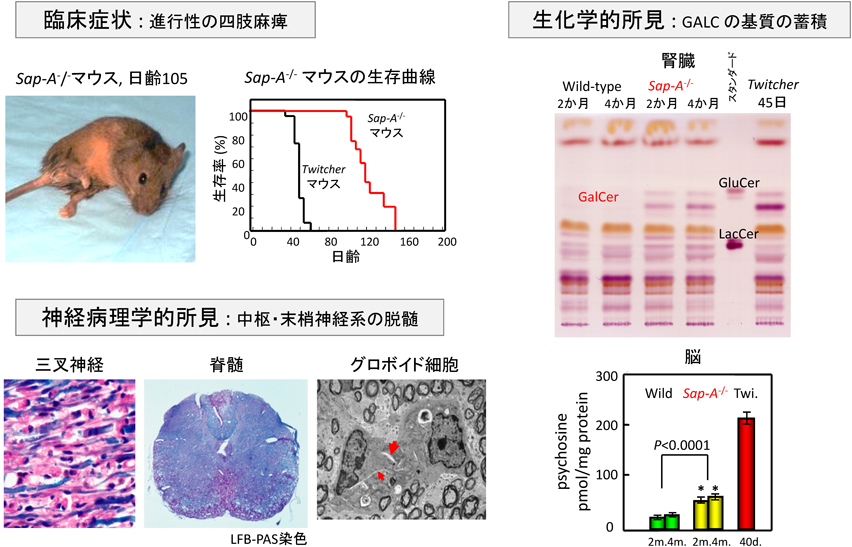
3) Sandhoff, K., Kolter, T., & Harzer, K.(2001) in The Metabolic and Molecular Basis of Inherited Disease (Scriver, C.R., Beaudet, A.L., Sly, W.S., et al. eds), p. 3371–3388, McGraw-Hill, New York.
14) O’Brien, J.S., Carson, G.S., Seo, H.-C., Hiraiwa, M., Weiler, S., Tomich, J.M., Barranger, J.A., Kahn, M., Azuma, N., & Kishimoto, Y. (1995) FASEB J., 9, 681–685.
22) Schnabel, D., Schröder, M., Fürst, W., Klein, A., Hurwitz, R., Zenk, T., Weber, J., Harzer, K., Paton, B.C., Poulos, A., Suzuki, K., & Sandhoff, K. (1992) J. Biol. Chem., 267, 3312–3315.
24) Hulková, H., Cervenková, M., Ledvinová, J., Tochácková, M., Hrebícek, M., Poupetová, H., Befekadu, A., Berná, L., Paton, B.C., Harzer, K., Böör, A., Smíd, F., & Elleder, M. (2001) Hum. Mol. Genet., 10, 927–940.
25) Millat, G., Verot, L., Rodriguez-Lafrasse, C., Di-Marco, J.N., Rimet, Y., Poujol, A., et al. (2003) in Book of Abstracts 14th ESGLD Workshop (Elleder, M., Ledvinová, J., Hřebíček, M., Poupetová, H., & Kožich, V. eds.), p. 81, Podebrady/Prague:Guarant Ltd., Prague, Czech.
26) Elleder, M., Jerábková, M., Befekadu, A., Hrebícek, M., Berná, L., Ledvinová, J., Hůlková, H., Rosewich, H., Schymik, N., Paton, B.C., & Harzer, K. (2005) Neuropediatrics, 36, 171–180.
28) Kuchar, L., Ledvinova, J., Hrebicek, M., Mysková, H., Dvoráková, L., Berná, L., Chrastina, P., Asfaw, B., Elleder, M., Petermöller, M., Mayrhofer, H., Staudt, M., Krägeloh-Mann, I., Paton, B.C., & Harzer, K. (2009) Am. J. Med. Genet., 149A, 613–621.
29) Motta, M., Tatti, M., Furlan, F., Celato, A., Di Fruscio, G., Polo, G., Manara, R., Nigro, V., Tartaglia, M., Burlina, A., & Salvioli, R. (2016) Clin. Genet., 90, 220–229.
44) Holtschmidt, H., Sandhoff, K., Kwon, H.Y., Harzer, K., Nakano, T., & Suzuki, K. (1991) J. Biol. Chem., 266, 7556–7560.
45) Henseler, M., Klein, A., Reber, M., Vanier, M.T., Landrieu, P., & Sandhoff, K. (1996) Am. J. Hum. Genet., 58, 65–74.
48) Sun, Y., Witte, D.P., Ran, H., Zamzow, M., Barnes, S., Cheng, H., Han, X., Williams, M.T., Skelton, M.R., Vorhees, C.V., & Grabowski, G.A. (2008) Hum. Mol. Genet., 17, 2345–2356.
55) Amsallen, D., Rodriguez, D., Vanier, M.T., Khayat, N., Millat, G., Campello, M., Guillaume, C., & Billette De Vilemeur, T. (2005) J. Inherit. Metab. Dis., 28, 1.
59) Hojo, H., Tanaka, H., Hagiwara, M., Asahina, Y., Ueki, A., Katayama, H., Nakahara, Y., Yoneshige, A., Matsuda, J., Ito, Y., & Nakahara, Y. (2012) J. Org. Chem., 77, 9437–9446.
67) Hashimoto, M. & Mikoshiba, K. (2003) J. Neurosci., 23, 11342–11351.
70) Jin, G., Kubo, H., Kashiba, M., Horinouchi, R., Hasegawa, M., Suzuki, M., Sagawa, T., Oizumi, M., Fujisawa, A., Tsukamoto, H., Yoshimura, S., & Yamamoto, Y. (2008) J. Clin. Biochem. Nutr., 42, 167–174.
71) Winau, F., Schwierzeck, V., Hurwitz, R., Remmel, N., Sieling, P.A., Modlin, R.L., Porcelli, S.A., Brinkmann, V., Sugita, M., Sandhoff, K., Kaufmann, S.H., & Schaible, U.E. (2004) Nat. Immunol., 5, 169–174.
73) Zhou, D., Cantu, C. 3rd, Sagiv, Y., Schrantz, N., Kulkarni, A.B., Qi, X., Mahuran, D.J., Morales, C.R., Grabowski, G.A., Benlagha, K., Savage, P., Bendelac, A., & Teyton, L. (2004) Science, 303, 523–527.
74) Zhou, D., Mattner, J., Cantu, C. 3rd, Schrantz, N., Yin, N., Gao, Y., Sagiv, Y., Hudspeth, K., Wu, Y.P., Yamashita, T., Teneberg, S., Wang, D., Proia, R.L., Levery, S.B., Savage, P.B., Teyton, L., & Bendelac, A. (2004) Science, 306, 1786–1789.
80) Nicholson, A.M., Finch, N.A., Almeida, M., Perkerson, R.B., van Blitterswijk, M., Wojtas, A., Cenik, B., Rotondo, S., Inskeep, V., Almasy, L., Dyer, T., Peralta, J., Jun, G., Wood, A.R., Frayling, T.M., Fuchsberger, C., Fowler, S., Teslovich, T.M., Manning, A.K., Kumar, S., Curran, J., Lehman, D., Abecasis, G., Duggirala, R., Pottier, C., Zahir, H.A., Crook, J.E., Karydas, A., Mitic, L., Sun, Y., Dickson, D.W., Bu, G., Herz, J., Yu, G., Miller, B.L., Ferguson, S., Petersen, R.C., Graff-Radford, N., Blangero, J., & Rademakers, R. (2016) Nat. Commun., 7, 11992.
81) Zhou, X., Sun, L., Bracko, O., Choi, J.W., Jia, Y., Nana, A.L., Brady, O.A., Hernandez, J.C.C., Nishimura, N., Seeley, W.W., & Hu, F. (2017) Nat. Commun., 8, 15277.
82) Zhou, X., Sullivan, P.M., Sun, L., & Hu, F. (2017) J. Neurochem., 2017, 22, Epub ahead of print.10.1111/jnc.14110
83) Sidransky, E., Nalls, M.A., Aasly, J.O., Aharon-Peretz, J., Annesi, G., Barbosa, E.R., Bar-Shira, A., Berg, D., Bras, J., Brice, A., Chen, C.M., Clark, L.N., Condroyer, C., De, M.E.V., Dürr, A., Eblan, M.J., Fahn, S., Farrer, M.J., Fung, H.C., Gan-Or, Z., Gasser, T., Gershoni-Baruch, R., Giladi, N., Griffith, A., Gurevich, T., Januario, C., Kropp, P., Lang, A.E., Lee-Chen, G.J., Lesage, S., Marder, K., Mata, I.F., Mirelman, A., Mitsui, J., Mizuta, I., Nicoletti, G., Oliveira, C., Ottman, R., Orr-Urtreger, A., Pereira, L.V., Quattrone, A., Rogaeva, E., Rolfs, A., Rosenbaum, H., Rozenberg, R., Samii, A., Samaddar, T., Schulte, C., Sharma, M., Singleton, A., Spitz, M., Tan, E.K., Tayebi, N., Toda, T., Troiano, A.R., Tsuji, S., Wittstock, M., Wolfsberg, T.G., Wu, Y.R., Zabetian, C.P., Zhao, Y., & Ziegler, S.G. (2009) N. Engl. J. Med., 361, 1651–1661.