2) King, N., Westbrook, M.J., Young, S.L., Kuo, A., Abedin, M., Chapman, J., Fairclough, S., Hellsten, U., Isogai, Y., Letunic, I., Marr, M., Pincus, D., Putnam, N., Rokas, A., Wright, K.J., Zuzow, R., Dirks, W., Good, M., Goodstein, D., Lemons, D., Li, W., Lyons, J.B., Morris, A., Nichols, S., Richter, D.J., Salamov, A., Sequencing, J.G.I., Bork, P., Lim, W.A., Manning, G., Miller, W.T., McGinnis, W., Shapiro, H., Tjian, R., Grigoriev, I.V., & Rokhsar, D. (2008) Nature, 451, 783–788.
4) Zimmermann, C., Chymkowitch, P., Eldholm, V., Putnam, C.D., Lindvall, J.M., Omerzu, M., Bjoras, M., Kolodner, R.D., & Enserink, J.M. (2011) Proc. Natl. Acad. Sci. USA, 108, 18748–18753.
6) Grimson, M.J., Coates, J.C., Reynolds, J.P., Shipman, M., Blanton, R.L., & Harwood, A.J. (2000) Nature, 408, 727–731.
7) Boury-Esnault, N., Ereskovsky, A., Bézac, C., Tokina, D., Ereskovsky, A., Bezac, C., & Tokina, D. (2003) Invertebr. Biol., 122, 187–202.
9) Schippers, K.J. & Nichols, S.A. (2017) bioRxiv, DOI: 10.1101/164012
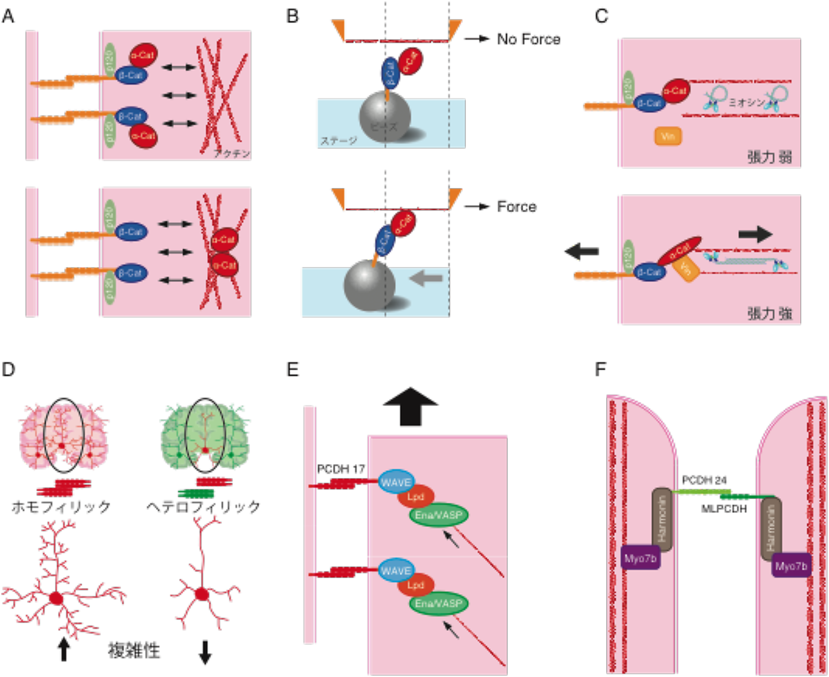
14) Buckley, C.D., Tan, J., Anderson, K.L., Hanein, D., Volkmann, N., Weis, W.I., Nelson, W.J., & Dunn, A.R. (2014) Science, 346, 1254211.
16) Wildenberg, G.A., Dohn, M.R., Carnahan, R.H., Davis, M.A., Lobdell, N.A., Settleman, J., & Reynolds, A.B. (2006) Cell, 127, 1027–1039.
22) Hayashi, S., Inoue, Y., Kiyonari, H., Abe, T., Misaki, K., Moriguchi, H., Tanaka, Y., & Takeichi, M. (2014) Dev. Cell, 30, 673–687.
23) Kazmierczak, P., Sakaguchi, H., Tokita, J., Wilson-Kubalek, E.M., Milligan, R.A., Müller, U., & Kachar, B. (2007) Nature, 449, 87–91.
24) Crawley, S.W., Shifrin, D.A. Jr., Grega-Larson, N.E., McConnell, R.E., Benesh, A.E., Mao, S., Zheng, Y., Zheng, Q.Y., Nam, K.T., Millis, B.A., Kachar, B., & Tyska, M.J. (2014) Cell, 157, 433–446.
28) Togashi, H., Kominami, K., Waseda, M., Komura, H., Miyoshi, J., Takeichi, M., & Takai, Y. (2011) Science, 333, 1144–1147.
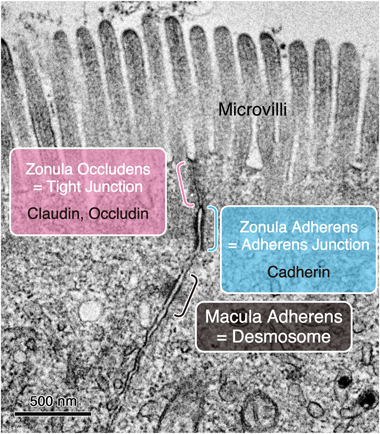
31) Furuse, M., Hirase, T., Itoh, M., Nagafuchi, A., Yonemura, S., Tsukita, S., & Tstlkita, S. (1993) J. Cell Biol., 123, 1777–1788.
33) Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., Tamura, A., Igarashi, M., Endo, T., Takeuchi, K., & Tsukita, S. (2011) FEBS Lett., 585, 606–612.
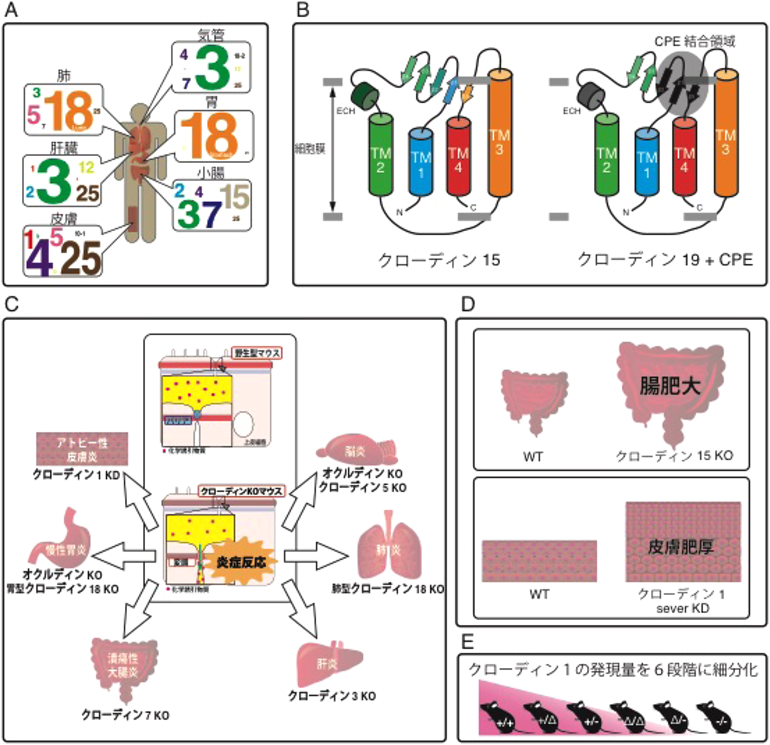
35) Krause, G., Winkler, L., Mueller, S.L., Haseloff, R.F., Piontek, J., & Blasig, I.E. (2008) Acta-Biomembr., 1778, 631–645.
36) Sonoda, N., Furuse, M., Sasaki, H., Yonemura, S., Katahira, J., Horiguchi, Y., & Tsukita, S. (1999) J. Cell Biol., 147, 195–204.
37) Tamura, A., Kitano, Y., Hata, M., Katsuno, T., Moriwaki, K., Sasaki, H., Hayashi, H., Suzuki, Y., Noda, T., Furuse, M., Tsukita, S., & Tsukita, S. (2008) Gastroenterology, 134, 523–534.
38) Hayashi, D., Tamura, A., Tanaka, H., Yamazaki, Y., Watanabe, S., Suzuki, K., Suzuki, K., Sentani, K., Yasui, W., Rakugi, H., Isaka, Y., & Tsukita, S. (2012) Gastroenterology, 142, 292–304.
39) Matsumoto, K., Imasato, M., Yamazaki, Y., Tanaka, H., Watanabe, M., Eguchi, H., Nagano, H., Hikita, H., Tatsumi, T., Takehara, T., Tamura, A., & Tsukita, S. (2014) Gastroenterology, 147, 1134–1145.e10.
40) McCarthy, K.M., Francis, S.A., McCormack, J.M., Lai, J., Rogers, R.A., Skare, I.B., Lynch, R.D., & Schneeberger, E.E. (2000) J. Cell Sci., 113, 3387–3398.
44) Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R., Dohmae, N., Tsukita, S., Nureki, O., & Fujiyoshi, Y. (2014) Science, 344, 304–307.
45) Saitoh, Y., Suzuki, H., Tani, K., Nishikawa, K., Irie, K., Ogura, Y., Tamura, A., Tsukita, S., & Fujiyoshi, Y. (2015) Science, 347, 775–778.
46) Ikenouchi, J., Furuse, M., Furuse, K., Sasaki, H., Tsukita, S., & Tsukita, S. (2005) J. Cell Biol., 171, 939–945.
47) Steed, E., Elbediwy, A., Vacca, B., Dupasquier, S., Hemkemeyer, S.A., Suddason, T., Costa, A.C., Beaudry, J.B., Zihni, C., Gallagher, E., Pierreux, C.E., Balda, M.S., & Matter, K. (2014) J. Cell Biol., 204, 821–838.
50) Saitou, M., Furuse, M., Sasaki, H., Schulzke, J.D., Fromm, M., Takano, H., Noda, T., & Tsukita, S. (2000) Mol. Biol. Cell, 11, 4131–4142.
52) Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., Noda, T., Kubo, A., & Tsukita, S. (2002) J. Cell Biol., 156, 1099–1111.
53) Tokumasu, R., Yamaga, K., Yamazaki, Y., Murota, H., Suzuki, K., Tamura, A., Bando, K., Furuta, Y., Katayama, I., & Tsukita, S. (2016) Proc. Natl. Acad. Sci. USA, 113, E4061–E4068.
55) Lee, J.-H., Koh, H., Kim, M., Kim, Y., Lee, S.-Y., Karess, R.E., Lee, S.-H., Shong, M., Kim, J.-M., Kim, J., & Chung, J. (2007) Nature, 447, 1017–1020.