黄色ブドウ球菌(Staphylococcus aureus)は皮膚や鼻腔に検出される常在性のグラム陽性球菌であり,種々の化膿性疾患や食中毒の原因菌である.黄色ブドウ球菌に対する宿主免疫では補体および好中球の関わる自然免疫が中心的な役割を果たしている.好中球の機能不全による慢性肉芽腫症や補体の欠損症では,黄色ブドウ球菌に対する抵抗性が低下し,この細菌に対する易感染が主要な症状として現れる.一方で黄色ブドウ球菌は「毒素のデパート」と形容されるほど多彩なタンパク質毒素を産生する.たとえば,古くから知られるα毒素やロイコシジンは標的細胞の細胞膜上で多量体を形成し,小孔を形成することで細胞傷害性を示す.toxic shock syndrome toxin-1(TSST-1)は,宿主免疫系の主要組織適合抗原(MHC)とT細胞抗原受容体(TCR)を抗原非依存的に架橋することでT細胞を非特異的に活性化するスーパー抗原活性を示し,宿主免疫系をかく乱する.黄色ブドウ球菌による食中毒において消化管症状を引き起こすエンテロトキシンもスーパー抗原活性を持つ.また,プロテインA(SpA)はIgGのFc領域に結合することで抗体の機能を妨害する.免疫学的な視点から考えると黄色ブドウ球菌の産生する毒素群は,宿主の免疫系の細胞や分子を標的として免疫をかく乱するタンパク質であると捉えることができる.近年も補体の活性化を抑制するSCIN(staphylococcal complement inhibitor),Ecb(extracellular complement-binding protein),Efb(extracellular fibrinogen-binding protein),接着分子intercellular adhesion molecule 1(ICAM-1)に結合するとともにエラスターゼ阻害作用を示すEap(extracellular adherence protein),アナフィラトキシンC5a受容体のアンタゴニストとして働くCHIPS(chemotaxis inhibitory protein of Staphylococcus aureus)やホルミルペプチド受容体のアンタゴニストとして働くFLIPr(formyl peptide receptor-like 1 inhibitory protein)などの新たな免疫かく乱タンパク質が見いだされている.本稿では,スーパー抗原に類似の構造を有する黄色ブドウ球菌毒素ファミリーstaphylococcal superantigen-like(SSL)タンパク質に関する最近の知見について我々の成果を中心に解説する.
SSLは,黄色ブドウ球菌の産生する分子量25,000~35,000の毒素様タンパク質である.14種のSSLが存在し,SSL1~SSL11は外毒素遺伝子クラスターであるGIαにタンデムにコードされ,SSL12~14は前述のEcb, Efbなどの免疫かく乱タンパク質とともにimmune evasion cluster 2(IEC2)にコードされている.SSLは分泌時に切断される20アミノ酸程度のシグナルペプチド,それに続くN末端側のOB(oligonucleotide/oligosaccharide-binding)foldとC末端側のβ-graspからなり,TSST-1やエンテロトキシンなどのスーパー抗原と類似の構造を持つ.SSLとスーパー抗原の間のアミノ酸配列の相同性は低く,さらに14種のSSLファミリー分子相互のアミノ酸配列の相同性もそれほど高くない(表1).SSLは以前staphylococcal enterotoxin-like toxin(SET)と呼ばれており,発見順にSET1, SET2,……と通し番号がつけられていた.しかしながらエンテロトキシンSETの発見により混乱が生じたため,新たにstaphylococcal superantigen-likeの名前が与えられるようになった.黄色ブドウ球菌が保有するSSLファミリー遺伝子の種類と数は菌株間で異なっていることが知られている.院内感染型のメチシリン耐性黄色ブドウ球菌(MRSA)に比べ,毒力が高いとされる市中感染型のMRSAの方が保持するSSLファミリーの遺伝子の数が多いこと,黄色ブドウ球菌が上皮細胞に貪食されたり,好中球のアズール顆粒と接触したりするとSSLの発現が誘導されることなどから,SSLは黄色ブドウ球菌の病原性に関わっていることが予想されていた.しかしながらSSLはスーパー抗原活性を示さず,その作用は明らかにされていなかった.
表1 SSLファミリーとエンテロトキシンSEAの相同性| SSL | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
|---|
| 1 | | | | | | | | | | | | | | |
| 2 | 31 | | | | | | | | | | | | | |
| 3 | 39 | 46 | | | | | | | | | | | | |
| 4 | 35 | 48 | 69 | | | | | | | | | | | |
| 5 | 40 | 37 | 38 | 41 | | | | | | | | | | |
| 6 | 34 | 38 | 44 | 46 | 39 | | | | | | | | | |
| 7 | 34 | 34 | 35 | 37 | 39 | 36 | | | | | | | | |
| 8 | 34 | 35 | 40 | 40 | 37 | 41 | 54 | | | | | | | |
| 9 | 32 | 31 | 37 | 40 | 36 | 37 | 54 | 69 | | | | | | |
| 10 | 33 | 28 | 33 | 34 | 35 | 29 | 39 | 40 | 43 | | | | | |
| 11 | 41 | 37 | 47 | 46 | 48 | 39 | 40 | 38 | 38 | 36 | | | | |
| 12 | 29 | 24 | 22 | 23 | 24 | 21 | 28 | 29 | 31 | 20 | 25 | | | |
| 13 | 27 | 19 | 20 | 23 | 24 | 39 | 23 | 27 | 24 | 23 | 25 | 58 | | |
| 14 | 29 | 33 | 23 | 25 | 26 | 24 | 34 | 27 | 25 | 24 | 26 | 62 | 69 | |
| SEA | 25 | 28 | 23 | 21 | 20 | 24 | 28 | 34 | 38 | 42 | 30 | 32 | 23 | 26 |
| NCTC8325株にコードされるSSLのアミノ酸配列を比較した.45%以上の相同性は薄灰色のハイライト,55%以上の相同性は濃灰色のハイライト(ともに太字)で示す. |
我々はSSL3の宿主側標的分子としてToll-like receptor 2(TLR2)を見いだした1).SSL3との相同性が高いSSL4もTLR2と結合することが示されている2).TLR2はマクロファージなどの免疫系細胞に発現するパターン認識受容体であり,黄色ブドウ球菌のリポペプチドなどをリガンドとする.TLR2や下流に存在するシグナル伝達分子Myd88のノックアウトマウスでは黄色ブドウ球菌に対して易感染であることから,この受容体は黄色ブドウ球菌に対する防御機序において重要であると考えられる.SSL3はTLR2の細胞外領域に結合するが,本来のリガンドとしては働かず,マクロファージを活性化することはない.逆にSSL3は黄色ブドウ球菌菌体やTLR2リガンドであるリポペプチドによるマクロファージからの炎症性サイトカイン(TNFαやIL-12)産生を強く抑制する.TLR2はTLR6あるいはTLR1と複合体を形成して機能的な受容体を構成するが,SSL3とTLR2複合体の結晶構造解析より,SSL3はTLR2とTLR6またはTLR1との複合体形成に関わる領域に結合することが示されている3).したがってSSL3は機能的なTLR2複合体の形成を妨げることで免疫細胞による黄色ブドウ球菌成分の認識と免疫の賦活化を妨げていると考えられる.
4. SSL5はPSGL-1とMMP-9を阻害する
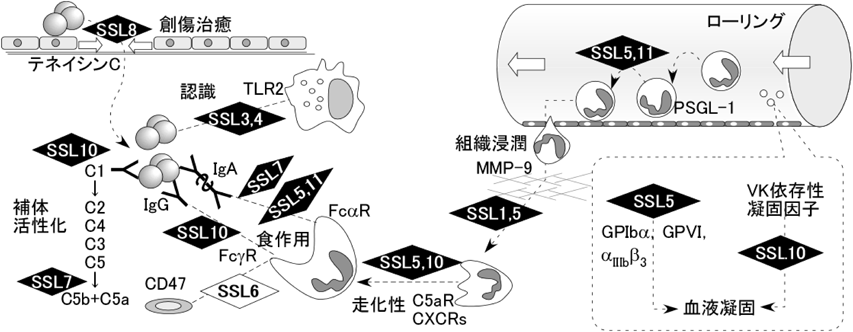
SSL5は,白血球表面に構成的に発現するシアリルルイスX糖鎖含有接着分子P-selectin glycoprotein ligand-1(PSGL-1)に結合することによって,活性化血管内皮細胞や血小板に発現する接着分子P-セレクチンとPSGL-1との相互作用を妨害し4),白血球の血管外遊走の前段階としての血管壁でのローリングを阻害する.SSL5とPSGL-1の結合は糖鎖依存的であり,白血球をシアリダーゼ処理することで両者の結合が消失する.SSL5は,補体活性化に伴う活性フラグメントC3aあるいはC5aに対する受容体および好中球走化性因子であるIL-8に対する受容体にも糖鎖を介して結合し,それらの機能をかく乱する.またSSL5は,血小板の細胞接着分子glycoprotein(GP)Ibα, GPVIおよびインテグリンαIIbβ3を介して血小板に結合するが5, 6),GPIbαあるいはGPVIとSSL5の結合もシアル酸含有糖鎖依存的である.SSL5以外にSSL2, SSL3, SSL4, SSL6およびSSL11でもC末端に存在するシアル酸含有糖鎖結合モチーフが保存されており,これらはシアリルラクトサミン含有糖鎖と結合する.一方,我々はSSL5が白血球の浸潤に関わる細胞外マトリックス分解酵素matrix metalloproteinase 9(MMP-9)を標的としていることを明らかにしている7).SSL5はMMP-9に選択的に結合し,そのプロテアーゼ活性を非競合的に阻害することにより,ヒト好中球の疑似基底膜に対する浸潤およびマウス腹腔へのチオグリコール酸培地誘導性の白血球浸潤を抑制する.最近SSL5以外にもSSL1がMMPに結合し,酵素活性を阻害することが示された8).したがって,SSL5は好中球の走化性,ローリングから血管壁への接着,組織浸潤の多段階の過程を阻害し,またSSL1はMMP-9の関わる組織浸潤の過程を妨げることで黄色ブドウ球菌感染部位への好中球のリクルートを妨げると考えられる.
黄色ブドウ球菌分泌タンパク質のファージディスプレイライブラリーのスクリーニングにより好中球結合分子としてSSL6が同定された9).SSL6はインテグリン結合タンパク質CD47を標的としており,CD47にシアル酸含有糖鎖依存的に結合する.CD47は食作用に対して抑制作用を持つことが知られており,SSL6は好中球による赤血球の貪食を促進する.SSL6-CD47相互作用が黄色ブドウ球菌に対する免疫にどのような作用を示すかについては,今後の解析が待たれる.
SSL7は,宿主側標的タンパク質が同定された初めてのSSLであり,粘膜免疫に関わるIgAと補体C5に結合する10).SSL7は霊長類とブタのIgAに結合するが,ヒツジ,ヤギ,ウサギ,マウスのIgAとは結合しない.一方でC5との結合は種特異性が低い.SSL7はIgAの定常部Cα2, Cα3ドメインの境界に結合することで,Fcα受容体へのIgAの結合を妨げる.この妨害作用によりIgAでオプソニン化された細菌の貪食と殺菌を妨げると考えられる.SSL7はC5に結合することで補体の活性化を妨げる.黄色ブドウ球菌はグラム陽性菌であるため,補体活性化の過程で生じる膜侵襲複合体による溶菌は起こらないが,C5の活性化の妨害により白血球の走化性に関わるC5aの生成が妨げられる.したがって,SSL7は黄色ブドウ球菌感染部位での補体活性化を妨害することにより,白血球のリクルートを妨げると考えられる.
母乳中にはIgA,ラクトフェリンなどの免疫活性物質が存在する.また黄色ブドウ球菌はウシの乳房炎の起因菌としても知られる.我々は,ヒト母乳よりSSL8結合タンパク質として細胞外マトリックスタンパク質テネイシンC(TNC)を見いだした11).TNCは胎生期や創傷・がんといった組織再構成が盛んな部位,時期に高発現し,細胞接着に対して正あるいは負に働くことが知られている.TNCはEGF様ドメイン,フィブロネクチン(FN)III様ドメイン1~8,フィブリノーゲン様ドメインからなり,EGF受容体,フィブリノーゲン,インテグリンなど複数の分子と相互作用するが,SSL8はFNIII4~5ドメインを介してテネイシンCと結合する.このドメインは,ヘパリン,インテグリン,FNとの結合に関与する.SSL8は,固相化ヘパリンへのTNCの結合やメラノーマ細胞のインテグリンα9依存性の固相化TNCへの接着には影響を与えないが,TNCとFNへの結合を抑制する.さらにSSL8は,TNCによるケラチノサイトのFNプレート上での伸展抑制を解除するとともに,TNC存在下でのケラチノサイトの細胞運動を抑制する.TNCは創傷の辺縁に発現してFNと相互作用し,創傷治癒を促進していることから,SSL8はTNCの機能を妨害し,創傷治癒を遅延させることで黄色ブドウ球菌感染の場を維持している可能性が考えられる.
8. SSL10はCXCR4, IgG,血液凝固因子に結合する
SSL10は,ケモカイン受容体CXCR4を標的とする12).SSL10とCXCR4の結合は,SSL5とPSGL-1やケモカイン受容体との結合と異なりシアリダーゼ処理の影響を受けず,シアル酸非依存的である.SSL10は,CXCR4リガンドであるstromal cell-derived factor 1(SDF-1)に対するJurkat T細胞の遊走を抑制する.CXCR4はさまざまな白血球に恒常的に発現していることから,SSL10が白血球のリクルートをかく乱することで,免疫回避に働いている可能性がある.我々は,SSL10がヒトIgG1に結合することを見いだしている13).SSL10はIgGのFc部に結合し,IgGと補体C1qの結合を妨害することで古典経路による補体活性化を妨げる.この補体活性化は,菌体表面でのC3bの沈着を引き起こし,好中球に存在するC3b受容体を介した効率的な貪食に重要である.またPatelらは,SSL10がフィブリノーゲンおよびフィブロネクチンとも結合すること,また好中球のFc受容体依存的な貪食を抑制することを示している14).SSL10は,好中球によるIgGとC3bによるオプソニン化を介した効率的な貪食を妨げることにより,黄色ブドウ球菌の免疫回避に働いていると考えられる.黄色ブドウ球菌はIgG結合タンパク質としてSpAとSbi(staphylococcal binder of IgG)を産生することが知られている.SpAとSbiのIgG結合ドメインは類似の構造を持っているが,SSL10はこれらとは異なった構造をしている.また,SpAとSbiは広範な動物種のIgGと結合するが,SSL10はヒトおよび霊長類のIgGとは結合するものの他の動物種のIgGとは結合しない.またSpAおよびSbiはIgG1, IgG2, IgG4と結合するが,SSL10はIgG1のみと結合する.さらにSpAとSbiは菌体表面に固定され,IgGのFc部を菌体側に配置することでIgGのエフェクター作用(オプソニン化や補体活性化)を妨げるが,SSL10は可溶性タンパク質として作用する.黄色ブドウ球菌の産生するこれら3種のIgG結合タンパク質は異なった状況においてIgGの機能に干渉すると考えられる.また我々はSSL10が血液凝固因子プロトロンビンにも結合することを見いだしている15).SSL10は血液凝固に対して抑制作用を示すが,活性型トロンビンのプロテアーゼ活性は阻害しない.SSL10は,プロトロンビンのGla(gamma-carboxyglutamic acid)ドメインに結合し,その結合にはγ-カルボキシグルタミン酸修飾が必要である.またSSL10はGlaを含む凝固因子VII, IX, Xにも結合する.したがって,SSL10は活性化血小板の表面で起こるビタミンK依存性凝固因子の活性化カスケードを抑制し,血液凝固を抑制すると考えられる.一方で黄色ブドウ球菌は,血液凝固を促進するコアグラーゼを産生することが古くから知られている.コアグラーゼはプロトロンビンに結合して構造変化を引き起こし,酵素活性を示すスタフィロトロンビンを生成することで凝固を促進する.なぜ黄色ブドウ球菌が血液凝固に対し相反する作用を示すタンパク質を産生するのだろうか? コアグラーゼは細胞壁に結合しているが,SSL10は可溶性タンパク質である.また我々は,SSL10がコアグラーゼによって引き起こされる血液凝固を阻害しないことを確認している.黄色ブドウ球菌はコアグラーゼにより菌体表面でのフィブリン凝集を引き起こし,免疫系からの認識を回避する一方で,SSL10によって宿主の生理的な凝固をかく乱している可能性がある.
我々および海外のグループの成果により,SSLファミリーは多彩な免疫関連分子の機能を阻害することが明らかにされつつある(表2).SSL5およびSSL3は,それぞれMMP-9, TLR2を阻害する初めてのタンパク質毒素である.SSLファミリーの宿主側標的分子は機能・構造的に無関係であり,SSLファミリーはユニークな毒素ファミリーであるといえる.SSLファミリーは黄色ブドウ球菌に対する防御機構を認識,ローリング,組織浸潤,走化性,補体活性化,食作用といった多くの段階で妨害する毒素ファミリーであることがわかってきた(図1).しかしながら半数のSSLは標的分子が未知のままである.アミノ酸配列相同性の低さから,各々のSSLは固有の機能を持っている可能性が高い.またSSL5, SSL7, SSL10が複数の分子を標的としていることから,SSLは多機能な毒素であるといえる.SSLの標的分子の多くが未知のままであると考えられる.標的分子が明らかにされたSSLについても,標的分子結合の詳細,病原性への寄与の証明などがなされていないものがあり,SSLファミリーの全容の解明はいまだ遠い.黄色ブドウ球菌は常在性細菌としても振る舞う身近な病原性細菌であり,薬剤耐性の獲得など公衆衛生上の脅威でもある.SSLファミリーの黄色ブドウ球菌の免疫回避,病態形成に関わる役割が明らかにされることで,黄色ブドウ球菌の毒力,定着性などの判定,黄色ブドウ球菌の常在性,感染性を標的とした治療法の開発に寄与すると考えている.
表2 SSLの標的分子と免疫応答に及ぼす影響| 名称 | 標的分子 | 免疫応答に及ぼす影響 | 文献 |
|---|
| SSL1 | MMP | 白血球の組織浸潤の阻害 | 8 |
| SSL3 | TLR2 | マクロファージによる認識を阻害 | 1,2,3 |
| SSL4 | TLR2 | マクロファージによる認識を阻害 | 2 |
| SSL5 | MMP-9 | 白血球の組織浸潤の阻害 | 7 |
| PSGL-1* | 白血球のローリングの阻害 | 4 |
| FcαR* | 食作用の阻害 | |
| GPCR* | 白血球の走化性の阻害 | |
| GPIbα*,GPVI*,αIIbβ3 | 血小板を活性化 | 5,6 |
| SSL6 | CD47* | 食作用の促進 | 9 |
| SSL7 | IgA | 食作用 | 10 |
| C5 | 補体活性化の阻害 | 10 |
| SSL8 | テネイシンC | 創傷治癒を遅延 | 11 |
| SSL10 | IgG | 補体活性化の阻害,食作用の阻害 | 13,14 |
| VK依存性凝固因子 | 血液凝固の阻害 | 15 |
| ホスファチジルセリン | ? | |
| CXCR4 | 白血球の走化性阻害作用 | 12 |
| SSL11 | FcαR* | 食作用を阻害 | |
| * SSL2, 3, 4, 5, 6, 11はシアリルラクトサミン糖鎖に結合する.これらのSSLは糖鎖を介して標的分子に結合する. |
謝辞Acknowledgments
本研究は文部科学省科学研究費補助金,大山健康財団,武田科学振興財団,愛知県がん研究振興会,鈴木謙三医科学応用研究財団,先進医学研究振興財団,名古屋市立大学特別研究奨励費の助成を受けて行いました.本研究を行うにあたり多くのご支援をいただきました星薬科大学と名古屋市立大学の先生方にお礼申し上げます.また共に研究に携わった星薬科大学と名古屋市立大学の学生と大学院生に感謝致します.
引用文献References
1) Yokoyama, R., Itoh, S., Kamoshida, G., Takii, T., Fujii, S., Tsuji, T., & Onozaki, K. (2012) Infect. Immun., 80, 2816–2825.
2) Bardoel, B.W., Vos, R., Bouman, T., Aerts, P.C., Bestebroer, J., Huizinga, E.G., Brondijk, T.H., van Strijp, J.A., & de Haas, C.J. (2012) J. Mol. Med. (Berl.), 90, 1109–1120.
3) Koymans, K.J., Feitsma, L.J., Brondijk, T.H., Aerts, P.C., Lukkien, E., Lossl, P., van Kessel, K.P., de Haas, C.J., van Strijp, J.A., & Huizinga, E.G. (2015) Proc. Natl. Acad. Sci. USA, 112, 11018–11023.
4) Bestebroer, J., Poppelier, M.J., Ulfman, L.H., Lenting, P.J., Denis, C.V., van Kessel, K.P., van Strijp, J.A., & de Haas, C.J. (2007) Blood, 109, 2936–2943.
5) de Haas, C.J., Weeterings, C., Vughs, M.M., de Groot, P.G., Van Strijp, J.A., & Lisman, T. (2009) J. Thromb. Haemost., 7, 1867–1874.
6) Hu, H., Armstrong, P.C., Khalil, E., Chen, Y.C., Straub, A., Li, M., Soosairajah, J., Hagemeyer, C.E., Bassler, N., Huang, D., Ahrens, I., Krippner, G., Gardiner, E., & Peter, K. (2011) PLoS One, 6, e19190.
7) Itoh, S., Hamada, E., Kamoshida, G., Takeshita, K., Oku, T., & Tsuji, T. (2010) Infect. Immun., 78, 3298–3305.
8) Koymans, K.J., Bisschop, A., Vughs, M.M., van Kessel, K.P., de Haas, C.J., & van Strijp, J.A. (2016) Int. J. Mol. Sci., •••, 17.
9) Fevre, C., Bestebroer, J., Mebius, M.M., de Haas, C.J., van Strijp, J.A., Fitzgerald, J.R., & Haas, P.J. (2014) Cell. Microbiol., 16, 1646–1665.
10) Langley, R., Wines, B., Willoughby, N., Basu, I., Proft, T., & Fraser, J.D. (2005) J. Immunol., 174, 2926–2933.
11) Itoh, S., Yamaoka, N., Kamoshida, G., Takii, T., Tsuji, T., Hayashi, H., & Onozaki, K. (2013) Biochem. Biophys. Res. Commun., 433, 127–132.
12) Walenkamp, A.M., Boer, I.G., Bestebroer, J., Rozeveld, D., Timmer-Bosscha, H., Hemrika, W., van Strijp, J.A., & de Haas, C.J. (2009) Neoplasia, 11, 333–344.
13) Itoh, S., Hamada, E., Kamoshida, G., Yokoyama, R., Takii, T., Onozaki, K., & Tsuji, T. (2010) Mol. Immunol., 47, 932–938.
14) Patel, D., Wines, B.D., Langley, R.J., & Fraser, J.D. (2010) J. Immunol., 184, 6283–6292.
15) Itoh, S., Yokoyama, R., Kamoshida, G., Fujiwara, T., Okada, H., Takii, T., Tsuji, T., Fujii, S., Hashizume, H., & Onozaki, K. (2013) J. Biol. Chem., 288, 21569–21580.
著者紹介Author Profile
 伊藤 佐生智(いとう さおとも)
伊藤 佐生智(いとう さおとも)名古屋市立大学大学院薬学研究科衛生化学分野准教授.博士(薬学).
略歴1971年愛知県生まれ.名古屋市立大学大学院薬学研究科博士課程修了(小野嵜菊夫教授),星薬科大学生化学教室,結核研究所基礎研究部,星薬科大学微生物学教室,名古屋市立大学大学院薬学研究科生体防御機能学分野(現衛生化学分野)を経て2016年より現職.
研究テーマと抱負生活環境,微生物と疾患の免疫を介した関係を探る.化学物質や細菌毒素や細菌構成成分が免疫関連疾患・生活習慣病その他各種疾患の発症・増悪にどのように関わっているかを解き明かしたい.
ウェブサイトhttp://www.nagoya-cu.ac.jp/phar/grad/iryo/bunshi/eisei.html
趣味以前は釣りと読書.最近はランニングと水泳と筋トレ.