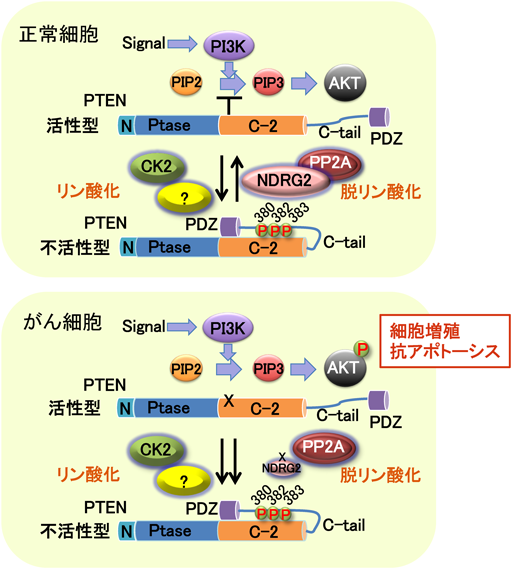
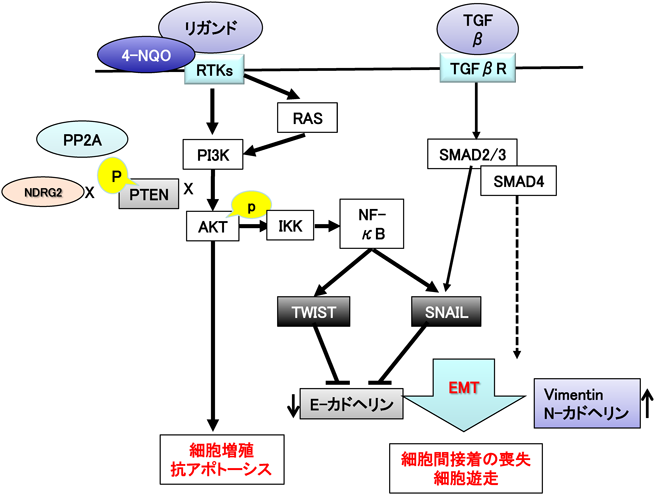
1) Nakahata, S., Ichikawa, T., Maneesaay, P., Saito, Y., Nagai, K., Tamura, T., Manachai, N., Yamakawa, N., Hamasaki, M., Kitabayashi, I., Arai, Y., Kanai, Y., Taki, T., Abe, T., Kiyonari, H., Shimoda, K., Ohshima, K., Horii, A., Shima, H., Taniwaki, M., Yamaguchi, R., & Morishita, K. (2014) Nat. Commun., 5, 3393.
2) Hu, W., Fan, C., Jiang, P., Ma, Z., Yan, X., Di, S., Jiang, S., Li, T., Cheng, Y., & Yang, Y. (2016) Oncotarget, 7, 209–223.
3) Leslie, N.R., Batty, I.H., Maccario, H., Davidson, L., & Downes, C.P. (2008) Oncogene, 27, 5464–5476.
4) Rahdar, M., Inoue, T., Meyer, T., Zhang, J., Vazquez, F., & Devreotes, P.N. (2009) Proc. Natl. Acad. Sci. USA, 106, 480–485.
6) Furuta, H., Kondo, Y., Nakahata, S., Hamasaki, M., Sakoda, S., & Morishita, K. (2010) Biochem. Biophys. Res. Commun., 391, 1785–1791.
7) Tamura, T., Ichikawa, T., Nakahata, S., Kondo, Y., Tagawa, Y., Yamamoto, K., Nagai, K., Baba, T., Yamaguchi, R., Futakuchi, M., Yamashita, Y., & Morishita, K. (2017) Cancer Res., 77, 2363–2374.
8) Ichikawa, T., Nakahata, S., Tamura, T., Manachai, N., & Morishita, K. (2015) Cell. Signal., 27, 2087–2098.
9) Ichikawa, T., Nakahata, S., Fujii, M., Iha, H., & Morishita, K. (2015) Sci. Rep., 5, 12841.