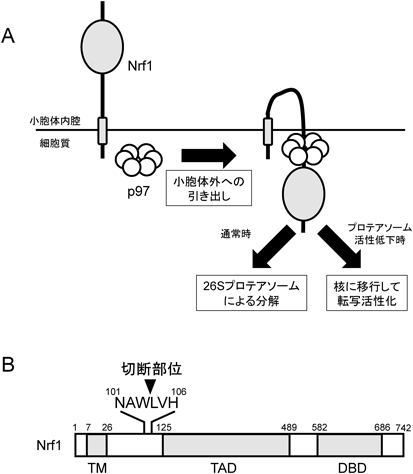
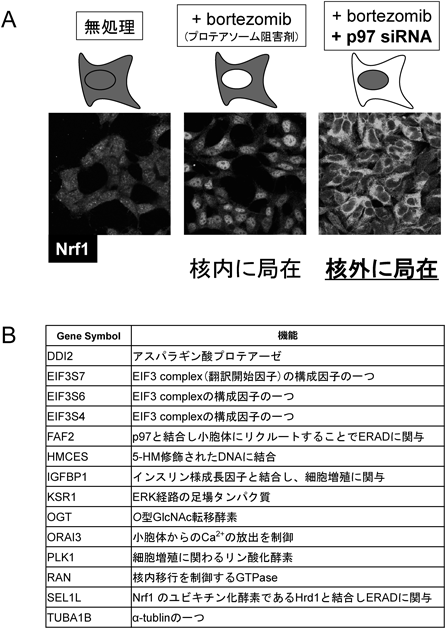
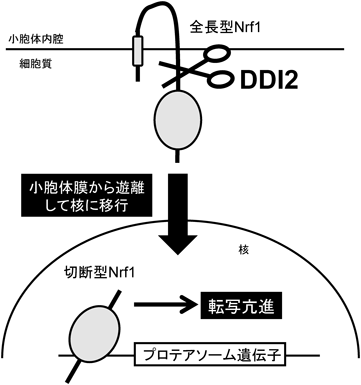
プロテアソーム発現制御転写因子Nrf1の活性化機構Activation Mechanism of Nrf1 for proteasome gene transcription
東京大学大学院薬学系研究科蛋白質代謝学教室Laboratory of Protein Metabolism, Graduate School of Pharmaceutical Sciences, the University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan