1) Kabe, Y., Hatakeyam, M., Nishio, K., & Handa, H. (2009) in Chemical Biology/Chemical Genetics, CMC press.
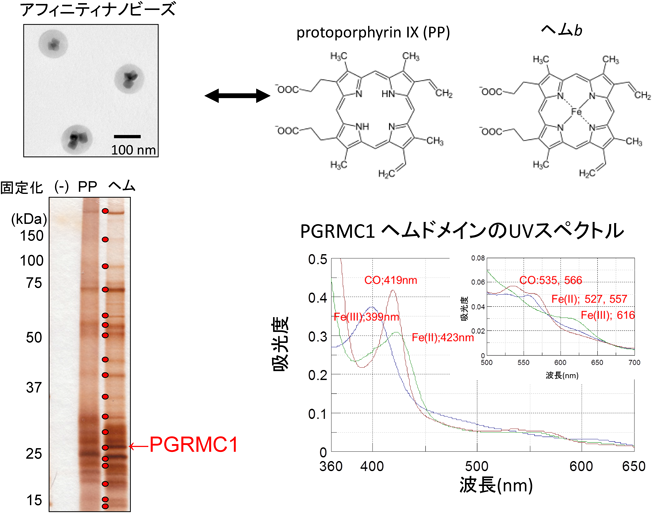
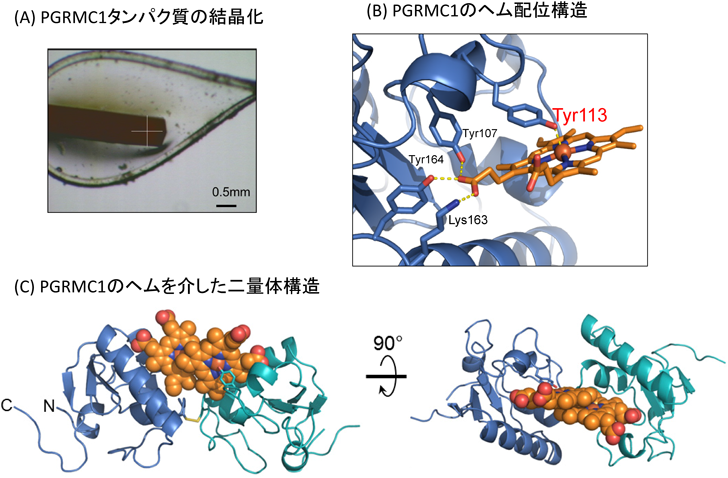
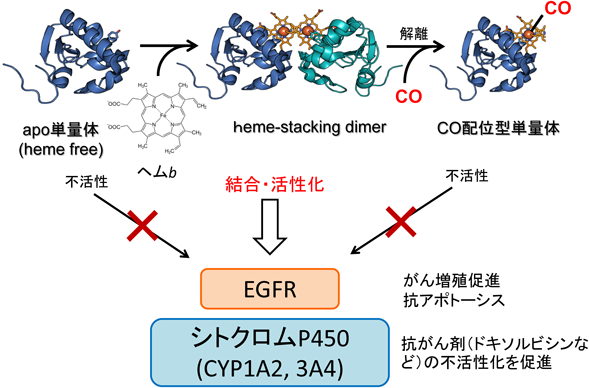
2) Kabe, Y., Nakane, T., Koike, I., Yamamoto, T., Sugiura, Y., Harada, E., Sugase, K., Shimamura, T., Ohmura, M., Muraoka, K., Yamamoto, A., Uchida, T., Iwata, S., Yamaguchi, Y., Krayukhina, E., Noda, M., Handa, H., Ishimori, K., Uchiyama, S., Kobayashi, T., & Suematsu, M. (2016) Nat. Commun., 7, 11030.
3) Kabe, Y., Yamamoto, T., Kajimura, M., Sugiura, Y., Koike, I., Ohmura, M., Nakamura, T., Tokumoto, Y., Tsugawa, H., Handa, H., Kobayashi, T., & Suematsu, M. (2016) Free Radic. Biol. Med., 99, 333–344.
4) Thom, S.R., Fisher, D., Xu, Y.A., Notarfrancesco, K., & Ischiropoulos, H. (2000) Proc. Natl. Acad. Sci. USA, 97, 1305–1310.
5) Thom, S.R., Fisher, D., Xu, Y.A., Garner, S., & Ischiropoulos, H. (1999) Am. J. Physiol., 276, H984–H992.
6) Kajimura, M., Fukuda, R., Bateman, R.M., Yamamoto, T., & Suematsu, M. (2010) Antioxid. Redox Signal., 13, 157–192.
7) Azuma, M., Kabe, Y., Kuramori, C., Kondo, M., Yamaguchi, Y., & Handa, H. (2008) PLoS One, 3, e3070.
8) Kabe, Y., Ohmori, M., Shinouchi, K., Tsuboi, Y., Hirao, S., Azuma, M., Watanabe, H., Okura, I., & Handa, H. (2006) J. Biol. Chem., 281, 31729–31735.
9) Ishikawa, H., Kato, M., Hori, H., Ishimori, K., Kirisako, T., Tokunaga, F., & Iwai, K. (2005) Mol. Cell, 19, 171–181.
10) Rohe, H.J., Ahmed, I.S., Twist, K.E., & Craven, R.J. (2009) Pharmacol. Ther., 121, 14–19.
11) Hughes, A.L., Powell, D.W., Bard, M., Eckstein, J., Barbuch, R., Link, A.J., & Espenshade, P.J. (2009) Cell Metab., 5, 143–149.
12) Izzo, N.J., Xu, J., Zeng, C., Kirk, M.J., Mozzoni, K., Silky, C., Rehak, C., Yurko, R., Look, G., Rishton, G., Safferstein, H., Cruchaga, C., Goate, A., Cahill, M.A., Arancio, O., Mach, R.H., Craven, R., Head, E., LeVine, H. 3rd, Spires-Jones, T.L., & Catalano, S.M. (2014) PLoS One, 9, e111899.