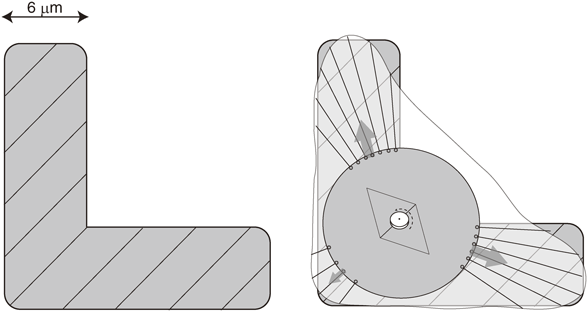
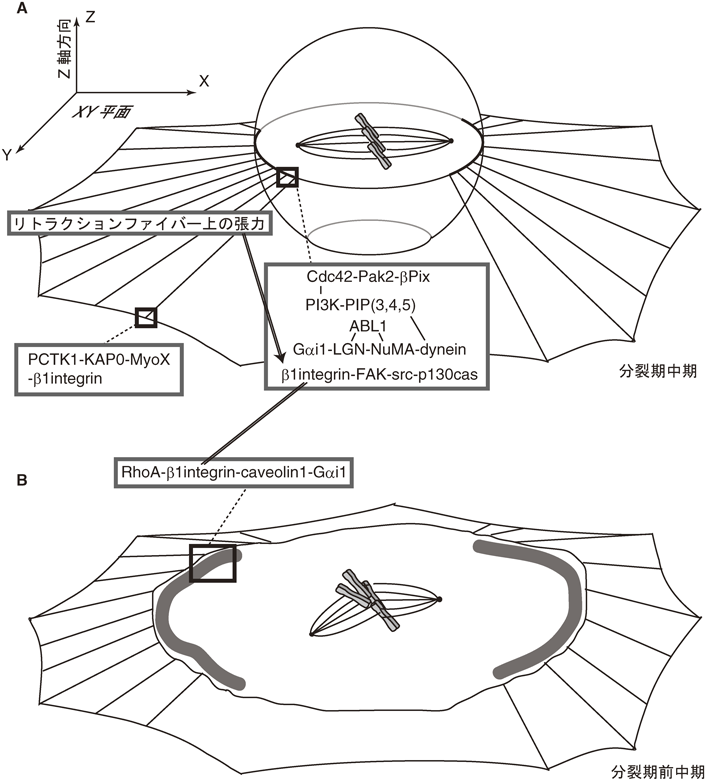
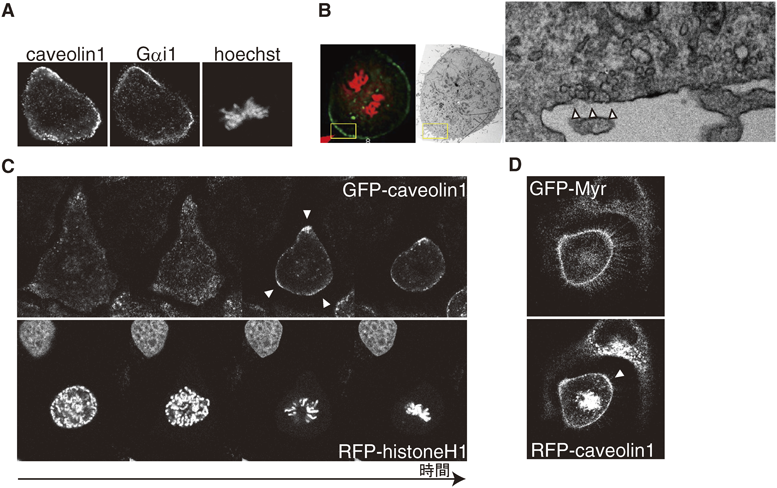
間期細胞形態による細胞分裂方向決定の分子メカニズムMolecular mechanisms for spindle orientation governed by adhesion geometry in interphase
京都大学ウイルス・再生医科学研究所・組織恒常性システム分野Lab. of Tissue Homeostasis, Department of Biosystems Science, Institute for Frontier Life and Medical Science, Kyoto University ◇ 〒606–8507 京都市左京区聖護院河原町53 ◇ Shogoin-kawaharachou53, Sakyo-ku, Kyoto 606–8507, Japan