膵臓ランゲルハンス島(膵島)β細胞から分泌されるインスリンは,血中グルコースの脂肪組織や筋組織への取り込みを促し,血糖値を低下させる.インスリンの分泌障害は高血糖を招き,2型糖尿病の一因となることから,その分泌機構が解明されることは病態の解明や治療薬の開発において重要である.
膵β細胞内で合成されたインスリンはインスリン顆粒に積み込まれ,小胞輸送によって細胞膜へと輸送される.血糖値の上昇によって細胞内にCa2+が流入すると,インスリン顆粒と細胞膜との融合および開口放出が生じる.この膜融合過程において中心的な役割を果たすのがSNARE(soluble N-ethylmaleimide sensitive factor attachment protein receptor)タンパク質である.本稿では膵β細胞に発現するSNAREタンパク質であるSNAP23(synaptosomal-associated protein 23)のインスリン分泌における機能と,SNAP23に結合する低分子化合物のインスリン分泌に対する効果について,我々の最近の研究成果を中心に紹介する.
2. インスリン分泌におけるSNAREタンパク質の役割
血糖値が上昇すると,血中グルコースは膵β細胞膜上に存在するグルコース輸送体のGLUT2によって細胞内へと取り込まれる.その後,解糖系などによって代謝されることでATPが産生されると,細胞膜上のSUR1とKir6.2からなるATP感受性K+チャネルが閉鎖する.それにより細胞膜の脱分極が生じると電位依存性Ca2+チャネルが開口し,Ca2+が細胞内へ流入する.この細胞内のCa2+濃度上昇がSNAREタンパク質による膜融合のトリガーとなる1).
インスリン顆粒にはv-SNARE(vesicle-SNARE)であるVAMP(vesicle-associated membrane protein)ファミリータンパク質が存在し,細胞膜にはt-SNARE(target-SNARE)であるsyntaxinファミリータンパク質とSNAP25ファミリータンパク質が存在する.これら三つのタンパク質が複合体を形成し,膜どうしを近接させて融合を促す2).これまでに,インスリン顆粒や膵β細胞膜に局在してインスリン分泌を促進するSNAREタンパク質として,v-SNAREのVAMP2やVAMP8,t-SNAREではsyntaxin1Aやsyntaxin3,syntaxin4, SNAP25が報告されている3–7).
インスリン分泌は他の調節性分泌と異なり,2相性の分泌過程をたどることが知られている.すなわち,グルコース刺激直後に起こる一過性の急激な第1相の分泌と,その後に起こる持続性の緩やかな第2相の分泌である.第1相では主に細胞膜と接している顆粒(ドッキング顆粒)の融合が起こり,第2相では細胞膜から離れた場所から輸送された顆粒の融合が起こると考えられている.ノックアウト(KO)マウスの解析などから,syntaxin1Aは第1相のドッキング顆粒の融合に特異的に働き5),一方,VAMP8やsyntaxin3は遠位から輸送された顆粒の融合に特異的に働いていることが示唆されている4, 6).このように,2相性の分泌過程はそれぞれ異なる機構によって制御されているが,詳細なメカニズムについてはまだ不明な部分が多い.
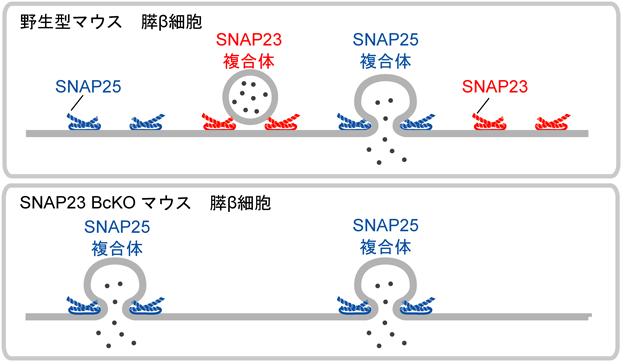
SNAP25ファミリーに属するSNAP23はSNAP25と同様,細胞膜に局在するt-SNAREタンパク質である.神経細胞や内分泌細胞にのみ発現するSNAP25とは異なり,SNAP23は膵β細胞を含む全身のさまざまな組織・細胞において発現が認められる.全身でのKOマウスは胎生致死となり,詳細な解析は行われていないが,ヘテロ接合体の表現型についてはいくつかの報告があり,神経細胞の樹状突起へのグルタミン酸受容体の輸送や,気管支上皮細胞からの粘液分泌が減少することが示されている8, 9).しかし,膵β細胞からのインスリン分泌におけるSNAP23の機能についてはこれまで解明されていなかった.そこで我々は膵β細胞特異的なSNAP23 KOマウス(SNAP23 BcKO)を作製し,表現型の解析を行った10).
SNAP23 BcKOマウスは出生し,外見上の異常はみられなかった.また,膵島の組織学的解析においても,特に異常はみられなかったため,糖代謝能について解析を行うこととした.仮に,SNAP23の欠損によってインスリン分泌が減少していた場合,マウスは耐糖能が悪化して高血糖となることが予想された.しかし,糖代謝の解析結果は予想とまったく逆であった.グルコースを投与したBcKOマウスの血糖値はコントロールマウスに比べ低くなっており,血漿中のインスリン量はBcKOマウスの方がコントロールマウスのおよそ2倍に増加していた.電子顕微鏡によるインスリン顆粒の観察では,顆粒の数やサイズに異常はみられなかったことから,BcKOマウスではインスリン顆粒の開口放出頻度が増加していることが予想された.このことを確かめるため,2光子励起顕微鏡や全反射顕微鏡を用いて単離膵島からのインスリン分泌を経時的に観察したところ,BcKOマウスの膵島ではコントロールマウスに比べ開口放出頻度が増加しており,特に第1相の分泌におけるドッキング顆粒の融合が選択的に増加していた.以上の結果から,SNAP23は膵β細胞においてドッキング顆粒の開口放出に抑制的に働いていることが示唆された.
このSNAP23によるインスリン分泌抑制のメカニズムについて,我々はSNAP23とSNAP25の膜融合効率の違いによって生じていると考えている.SNAP23はsyntaxin1A, VAMP2と結合するが,SNAP25と違い,刺激後のすばやい開口放出を起こすことができないことが神経細胞や神経内分泌細胞において解析されている11, 12).このような違いが膵β細胞におけるドッキング顆粒の開口放出頻度の制御に関わっていると考えられる.つまり,膵β細胞にはSNAP25-syntaxin1A-VAMP2によるドッキング顆粒とSNAP23-syntaxin1A-VAMP2によるドッキング顆粒が存在し,グルコース刺激後に前者はすばやく開口放出を起こすが後者は起こすことができず,分泌量が抑えられるということである.一方,BcKOマウスの膵β細胞においては,SNAP25-syntaxin1A-VAMP2によるドッキング顆粒が増加するため,第1相の分泌が増加したと考えられる(図1).
4. SNAP23結合化合物によるインスリン分泌の促進
SNAP23 BcKOマウスの表現型を受けて,我々は,膵β細胞においてSNAP23を阻害すればインスリン分泌を増加させることができ,糖尿病治療につながるのではないかと考えた.そこで,理化学研究所ケミカルバイオロジー研究グループと共同でSNAP23に結合する低分子化合物の探索を行った.SNAP23とSNAP25の精製タンパク質を用いて,多くの微生物代謝産物を含むRIKEN NPDepo化合物ライブラリーのスクリーニングを行った結果,SNAP23への結合が強く,SNAP25への結合は弱い5種類の化合物が得られた.これらの化合物をマウス膵β細胞株であるMIN6細胞に作用させ,グルコース刺激後のインスリン分泌量を測定したところ,5種類の化合物のうちMF286という化合物だけがインスリン分泌を有意に増加させることがわかった.そこで,MF286が個体においてもインスリン分泌を増加させることができるか,野生型マウスに投与して糖代謝の解析を行った.その結果,MF286投与マウスはグルコース投与後の血糖値上昇が抑制され,血漿インスリン量はコントロールマウスのおよそ1.5倍に増加していた(図2).以上の結果から,MF286はマウス個体においてもインスリン分泌を増加させる効果があることが示された.
では,MF286はどのようにインスリン分泌を増加させているのか.我々はSNAP23とsyntaxin1A, VAMP2との結合の変化に注目し,精製タンパク質を用いて検討を行った.SNAP23とsyntaxin1A, VAMP2を試験管内で混合すると三つのタンパク質は複合体を形成するが,MF286存在下ではVAMP2の結合が著しく阻害された.この阻害効果はSNAP23-syntaxin4-VAMP2の複合体においてはみられなかったことから,MF286はSNAP23とsyntaxin1A, VAMP2との複合体形成を選択的に阻害すると考えられる.以上の結果から,MF286が作用した膵β細胞においてはSNAP23-syntaxin1A-VAMP2の複合体形成が阻害されることによってSNAP25-syntaxin1A-VAMP2複合体が増加し,開口放出の増加につながったと考えられる.
本研究により,SNAP23は膵β細胞においてSNAP25とsyntaxin1A, VAMP2との結合を競合阻害することでインスリン分泌に抑制的に機能していることが明らかとなった.最近,膵β細胞に発現するもう一つのt-SNAREタンパク質であるsyntaxin2のKOマウスにおいてもインスリン分泌が増加する表現型が報告され,インスリン分泌に抑制的に働いていることが示唆されている13).このように,SNAREタンパク質によるインスリン分泌の調節は単に分泌を促進する働きだけでなく,分泌にブレーキをかける役割を果たしているものもあることがわかってきた.これはおそらく,グルコース刺激時の過剰な分泌や非刺激時での異常な分泌によって低血糖となってしまうことを防ぐためではないかと推測されるが,その意義についてはまだ不明である.このことを明らかにするために,今後,SNAREタンパク質によるインスリン分泌制御機構がさらに詳しく解明される必要があると考える.
本研究ではさらに,SNAP23結合化合物であるMF286がインスリン分泌を増加させる効果があることを明らかにした.このことはSNAP23が糖尿病治療薬の新しいターゲットになる可能性を示唆している.現在,インスリン分泌を促進する薬剤としてはスルホニルウレアやグリニド系といったものが使用されている.これらは膵β細胞膜上のATP感受性K+チャネルに作用し,強制的に膜の脱分極を起こすことで分泌を誘導するため,グルコース非依存的な分泌を起こして低血糖を招く可能性がある.一方,SNAP23を標的とするMF286は分泌の最終段階に作用するので,脱分極はあくまでも血中グルコースに依存する.そのため,低血糖を起こしにくい,より安全な薬剤となる可能性が考えられる.今後,MF286の効果や安全性についてさらに解析していきたいと考えている.
謝辞Acknowledgments
本研究を遂行するにあたり,KOマウスの解析や化合物の探索にご尽力いただいた共同研究者の先生方,また,教室員の皆様に感謝いたします.
引用文献References
1) Hou, J.C., Min, L., & Pessin, J.E. (2009) Vitam. Horm., 80, 473–506.
2) Hong, W. & Lev, S. (2014) Trends Cell Biol., 24, 35–43.
3) Regazzi, R., Wollheim, C.B., Lang, J., Theler, J.-M., Rossetto, O., Montecucco, C., Sadoul, K., Weller, U., Palmer, M., & Thorens, B. (1995) EMBO J., 14, 2723–2730.
4) Zhu, D., Zhang, Y., Lam, P.P., Dolai, S., Liu, Y., Cai, E.P., Choi, D., Schroer, S.A., Kang, Y., Allister, E.M., Qin, T., Wheeler, M.B., Wang, C.C., Hong, W.J., Woo, M., & Gaisano, H.Y. (2012) Cell Metab., 16, 238–249.
5) Ohara-Imaizumi, M., Fujiwara, T., Nakamichi, Y., Okamura, T., Akimoto, Y., Kawai, J., Matsushima, S., Kawakami, H., Watanabe, T., Akagawa, K., & Nagamatsu, S. (2007) J. Cell Biol., 177, 695–705.
6) Zhu, D., Koo, E., Kwan, E., Kang, Y., Park, S., Xie, H., Sugita, S., & Gaisano, H.Y. (2013) Diabetologia, 56, 359–369.
7) Spurlin, B.A. & Thurmond, D.C. (2006) Mol. Endocrinol., 20, 183–193.
8) Suh, Y.H., Terashima, A., Petralia, R.S., Wenthold, R.J., Isaac, J.T.R., Roche, K.W., & Roche, P.A. (2010) Nat. Neurosci., 13, 338–343.
9) Ren, B., Azzegagh, Z., Jaramillo, A.M., Zhu, Y., Pardo-Saganta, A., Bagirzadeh, R., Flores, J.R., Han, W., Tang, Y.J., Tu, J., Alanis, D.M., Evans, C.M., Guindani, M., Roche, P.A., Rajagopal, J., Chen, J., Davis, C.W., Tuvim, M.J., & Dickey, B.F. (2015) Biosci. Rep., 35, e00220.
10) Kunii, M., Ohara-Imaizumi, M., Takahashi, N., Kobayashi, M., Kawakami, R., Kondoh, Y., Shimizu, T., Simizu, S., Lin, B., Nunomura, K., Aoyagi, K., Ohno, M., Ohmuraya, M., Sato, T., Yoshimura, S.-I., Sato, K., Harada, R., Kim, Y.J., Osada, H., Nemoto, T., Kasai, H., Kitamura, T., Nagamatsu, S., & Harada, A. (2016) J. Cell Biol., 215, 121–138.
11) Sørensen, J.B., Nagy, G., Varoqueaux, F., Nehring, R.B., Brose, N., Wilson, M.C., & Neher, E. (2003) Cell, 114, 75–86.
12) Delgado-Martinez, I., Nehring, R.B., & Sørensen, J.B. (2007) J. Neurosci., 27, 9380–9391.
13) Zhu, D., Xie, L., Kang, Y., Dolai, S., Bondo Hansen, J., Qin, T., Xie, H., Liang, T., Rubin, D.C., Osborne, L., & Gaisano, H.Y. (2017) Diabetes, 66, 948–959.
著者紹介Author Profile
 國井 政孝(くにい まさたか)
國井 政孝(くにい まさたか)大阪大学大学院医学系研究科助教.博士(医学).
略歴1981年埼玉県に生まれる.2005年群馬大学医学部保健学科卒業.11年同大学院医学系研究科博士課程修了.同年より現職.
研究テーマと抱負細胞内輸送,分泌制御機構と細胞・組織形態形成との関連を基本に,疾患の病態解明や臨床応用へとつながるような研究を手掛けたい.
趣味国内外のクラフトビールの試飲.
 原田 彰宏(はらだ あきひろ)
原田 彰宏(はらだ あきひろ)大阪大学大学院医学系研究科細胞生物学教室教授.博士(医学)
略歴1963年神奈川県に生まれる.89年東京大学医学部医学科卒業.89年東京大学医学部附属病院内科医員(研修医).90年東京大学大学院医学系研究科博士課程入学.92年同博士課程中退.同年寄付講座教員,東京大学薬学部機能病態学教室助手相当.95年東京大学医学部附属脳研究施設脳解剖学教室文部教官助手.96年同文部教官講師.97年東京大学大学院医学系研究科細胞生物学解剖学大講座文部教官講師.2001年群馬大学生体調節研究所細胞構造分野文部科学教官教授.04年国立大学法人群馬大学生体調節研究所細胞構造分野教授.09年国立大学法人大阪大学大学院医学系研究科細胞生物学教授.
研究テーマと抱負細胞の極性形成における極性輸送の分子機構の解明,特にアピカル面は微絨毛や繊毛などの特徴のある構造物が多い割に,アピカル面の形成やアピカル面への輸送の分子機構はよく知られていないため,その解明を目指しています.
ウェブサイトhttp://www.med.osaka-u.ac.jp/pub/acb/
趣味映画鑑賞.