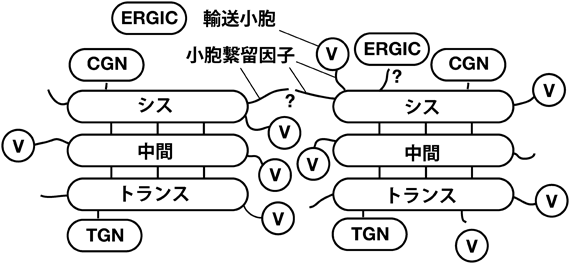
ゴルジ体は分泌経路の中央に位置するオルガネラであり,小胞体から新規合成された膜タンパク質や分泌タンパク質を受け取り,糖鎖付加や組換え,ペプチド鎖の切断などの修飾を施したのち,配送先に応じて選別して送り出している.ゴルジ体は,また,スフィンゴミエリンなどの膜脂質の合成の場でもある.真核生物のゴルジ体は扁平な槽(嚢)が積み重なった層板構造を持ち,この層板は小胞体からタンパク質を受け取るシス側と,修飾の完成したタンパク質を選別し発送するトランス側に分極している(図1).さらに哺乳類の細胞では,層板が側方でつながり合って中心体近傍に集積してリボン状の構造を形成している1, 2).
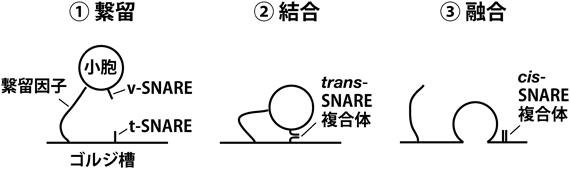
ゴルジ体層板間での新規合成タンパク質の輸送は小胞輸送によって担われている.新規合成タンパク質(以降積荷と呼ぶ)は,小胞体からCOPII小胞に積載して発送される.COPII小胞は,ERGIC(ER-Golgi intermediate compartment)と呼ばれる小胞体とゴルジ体の中間区画と融合し,積荷を乗せたERGICはダイニンモーターにより,微小管に沿って中心体付近にあるゴルジ体層板近傍へと運ばれる.ゴルジ体層板には一群の小胞繋留因子が局在しており,小胞体からきた輸送小胞は,シスゴルジネットワーク(cis-Golgi network:CGN)と融合し(ERGICとCGNはつながった同じコンパートメントであるとの説もある),小胞繋留因子の特異性によってシス側に繋留される(図1).繋留された輸送小胞が,ゴルジ体の槽に接近すると,輸送小胞のSNARE(v-SNARE)と槽のSNARE(t-SNARE)の働きによって正しい融合相手であるかどうか,最終的な照合が行われると同時に膜融合が起こり,積荷が槽内へと受けわたされる(図2).積荷はゴルジ体層板をシスからトランスへと運ばれると同時に修飾される.
ゴルジ体層板で積荷がシスからトランスへと運ばれる機構には不明の点が多く残されているが,層板がエスカレーターの段のようにシスからトランスへと動くことによって積荷を運んでいるとする「槽成熟仮説」が多くの研究者の支持を得ている.しかし,シスからトランスへと固定されて配置された槽の間を行き来する輸送小胞が積荷を運んでいるとする「小胞輸送仮説」を支持する研究者もいる2).
トランス槽に達した積荷は,さらにトランスゴルジネットワーク(trans-Golgi network:TGN)と呼ばれる区画に入り,目的地別に選別されて輸送小胞へ積み込まれ発送される(図1).目的地別の積荷の選別積載は,クラスリン被覆とそのアダプタータンパク質が担っている3).TGNからの輸送小胞はエンドソームを経て,最終目的地であるリソソームや細胞膜へ輸送され,分泌タンパク質は細胞外へと放出される.
ゴルジ体が層板構造やリボン状構造を形成する生理的意義には不明の点が多く残されているが,分泌タンパク質や膜タンパク質の効率的な修飾や修飾品質の維持,また,輸送先の正確性の担保に必要であるとの報告がある.また,これから述べるように,ゴルジ体の構造を乱すと糖鎖修飾の効率や品質が低下し,糖鎖合成異常症の原因となることや,ペプチド鎖切断の不全によりアミロイドβ(Aβ)の蓄積を誘導してアルツハイマー病を誘発することなど,各種疾患の原因となることが明らかになってきている.また,膜タンパク質や分泌タンパク質の極性輸送の不全が生じ細胞極性に異常が生じると同時に,細胞運動の異常が引き起こされ,発がんの原因ともなることが明らかになりつつある.
リソソームやミトコンドリアの機能不全に関連する疾患が古くから知られ解析されてきたのに比べて,ゴルジ体の異常を原因とする疾患の発見は比較的新しい.この理由は,ゴルジ体を介した小胞輸送経路やゴルジ体の機能が細胞の生存と増殖に必須であり,ゴルジ体の機能や構造の異常を引き起こす変異の多くが胎生致死を誘導し,遺伝病として成立しないことがあるのであろう4).一方,近年の研究から,ゴルジ体の構造維持やゴルジ体周辺での小胞輸送の調節・維持,特に輸送小胞の繋留過程には多種類の因子が重複した機能を果たす冗長性があり,ゴルジ体の機能や構造には高度の頑強性があることが明らかとなってきた5).したがって,ゴルジ体タンパク質の異常を原因とする疾患は多因子性の遺伝性疾患となり,従来の遺伝学的手法からは発見を免れてきた可能性が考えられる.近年のゲノム解析技術の向上に伴い,ゴルジ体に局在する酵素群以外の構造タンパク質や調節タンパク質の変異がヒトの遺伝性疾患の原因遺伝子として同定されつつある.これらの遺伝病はゴルジ体病(Golgipathies)と名づけられ,原因遺伝子は,これら疾患の診断や創薬・治療の標的として注目を集めている6, 7).
1)先天性糖鎖合成異常症(CDG)
以前から,ゴルジ体に局在する糖転移酵素の変異が,糖鎖修飾の異常を引き起こし,精神運動発達遅滞や特徴的顔貌などの症候群を伴う先天性糖鎖合成異常症(congenital disorder of glycosylation:CDG)と呼ばれる希少な遺伝病の原因となることが知られていた8).近年,ゴルジ体層板の細胞質側に局在するタンパク質複合体であるCOG(conserved oligomeric Golgi)のサブユニットの変異がCDGの原因となることが明らかになってきた9).COGは,八つのサブユニットからなる複合体であり,SNAREやRabタンパク質と相互作用して,ゴルジ層板の下流(トランス側)から上流(シス側)への逆行輸送を促進する.COGの変異により糖転移酵素の逆行輸送の不全が起こり,その結果,ゴルジ体糖転移酵素の局在異常が引き起こされ,糖鎖合成異常が起こるものと考えられる.糖タンパク質の合成異常は,神経機能の不全や軟骨形成の異常を導き,CDGを発症させるものと考えられる9).
2)神経変性疾患
アルツハイマー病や筋萎縮性側索硬化症(ALS),パーキンソン病,ハンチントン病などの神経変性疾患で,ゴルジ体の分散などの形態異常が頻繁に観察される.また,ゴルジ体の形態異常が,疾患の発症に先立ってみられることから,疾患発症に伴う単なる結果としての病変ではなく,疾患発症の素因となっている可能性が考えられる10–12).特にアルツハイマー病でアミロイド形成を導くAβの生成は,ゴルジ体に局在するγセクレターゼとβセクレターゼの機能的バランスの変化に大きく影響されるため,ゴルジ体の形態的機能的変化がこのバランスに影響を与え,Aβの生成を促進している可能性が考えられる.また,Tauの過剰リン酸化が微小管の形成異常を介して引き起こすゴルジ体の形態異常も,Aβの生成の促進に寄与している可能性がある10).微小管とゴルジ体の形態の相互関係については後述する.
3)発がん
近年の遺伝学的解析やトランスクリプトーム解析から,ゴルジ体に局在する複数のタンパク質の異常が発がんに関与していることが明らかになってきた.これらのタンパク質の異常は,ゴルジ体での糖鎖修飾や極性輸送などの古典的な分泌経路の異常を介してだけでなく,ゴルジ体を足場とした情報伝達経路を介して細胞増殖や運動の制御に関与しているようである13–15).中でもGOLPH3やCdc42とその関連因子群は,ゴルジ体と細胞骨格や情報伝達系をつなぐ因子として腫瘍形成を含めてさまざまな疾患に関連していることが示唆されている.
a.GOLPH3
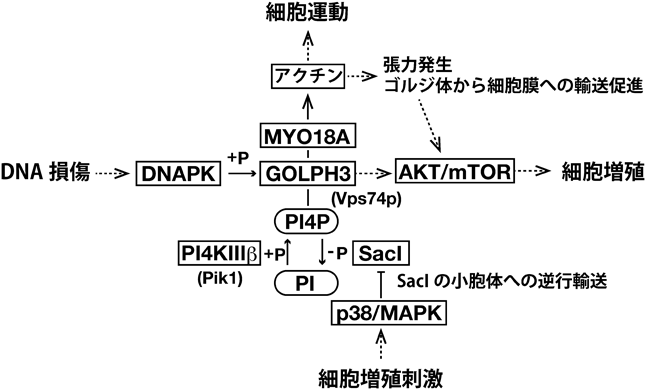
GOLPH3(GMx33, GPP34)は,ゴルジ体のプロテオーム解析から,トランスゴルジに局在するタンパク質として発見された14, 16).GOLPH3の酵母相同遺伝子産物はVps74pであり,ゴルジ体に局在する糖転移酵素群の細胞質領域と結合し,ゴルジ体での糖転移酵素の局在を調節しているとの報告がある14, 16).哺乳類のGOLPH3は,主としてトランスゴルジに集積しているホスファチジルイノシトール4-リン酸(PI4P)によってゴルジ体へ結合し,定形外(unconventional)ミオシンであるMYO18Aを介してアクチン繊維と結合する(図3).これによって,GOLPH3はゴルジ体に張力を与え,ゴルジ体のリボン構造の引き延ばしや,トランス側からの輸送小胞の送り出しを促進しているらしい14, 16).
一方,トランスクリプトーム解析から,GOLPH3は,肺がん,卵巣がん,乳がん,前立腺がん,黒色腫などの複数の固形腫瘍で共通して発現増強がみられる新しいがん遺伝子であることが明らかとなった14, 16).GOLPH3の発現増強は,mTOR経路の活性化を引き起こし,細胞増殖を引き起こすようである(図3).先に述べたGOLPH3のアクチン繊維との相互作用によるゴルジ体の形態や分泌経路への機能変化が,mTOR経路の活性化に関わっている可能性もある14, 16).
細胞増殖刺激によってp38/MAPK経路の情報伝達系が活性化することがよく知られている.p38/MAPKは,PI4PのホスファターゼであるSacIを抑制して,PI4Pを増加させる(図3).したがって,p38/MAPK経路の活性化は,ゴルジ体のGOLPH3を増加させその活性の上昇を導くと考えられる14, 16).
興味深いことに,DNA損傷が,DNAPKによるGOLPH3のリン酸化を介して,GOLPH3-MYO18A系を活性化させ,ゴルジ体を分散させることも報告されている(図3)14, 16).この反応は,DNA損傷下で細胞が生き残るための応答反応であると推測されているが,先に述べたGOLPH3の活性化が細胞増殖や細胞運動を促進することと単純に考え合わせると,DNA損傷を受けた細胞の増殖がGOPLH3を介して促され,発がんを促進する方向に働くことが予想される.このことから,GOPLH3を介した反応経路はがんの治療標的として注目されている17).
b.Cdc42
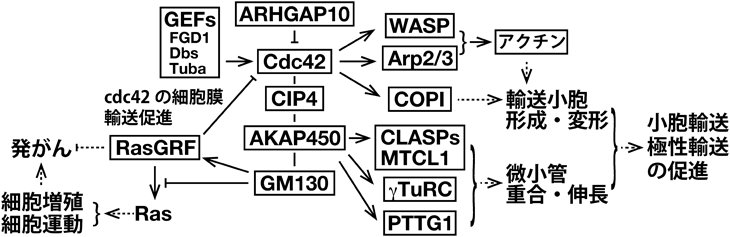
Cdc42pは酵母の細胞周期進行に必須の因子として発見されたRhoファミリーの小型GTPaseである13, 15).酵母での初期の研究から,細胞膜に局在しアクチン繊維の形成を制御することで極性輸送に関わることが示唆されていた.哺乳類の相同遺伝子産物Cdc42も,細胞膜でのアクチン繊維の動態を調節することで,細胞極性や細胞運動を調節していることが報告されている13, 15).しかしながら,哺乳類のCdc42は,ゴルジ体にも局在していることが明らかとなっており,N-WASPやArp3をゴルジ層板の側方端へと誘引し,アクチン繊維の重合を促進するとともに,ゴルジ体から小胞体への逆行輸送を促進することが示唆されている(図4)13, 15).
Cdc42はまた,ARF1やCOPI被覆と相互作用することで,ゴルジ体層板での順行輸送や,ゴルジ体層板から小胞体への逆行輸送を促進することも明らかとなっている13, 15).さらに最近,COPI被覆と相互作用して,通常のCOPI小胞とは異なる,管状の輸送小胞を形成させることも報告された18).ゴルジ体からの輸送小胞の形成がアクチン細胞骨格系によって調節されている可能性が示唆され興味深い.
一方Cdc42は微小管系とも連関している.COPI被覆小胞とdyneinの結合を,Cdc42が競合的に阻害することや,Cdc42の不活性化によって,ゴルジ体の中心体付近への集積が阻害されることから13, 15),Cdc42が微小管モーターを介して,COPI被覆小胞やゴルジ体層板の動態を調節している可能性が示唆されている19).
Cdc42の活性は,FGD1, Dbs, Tubaなどのゴルジ体に局在する複数のGEF(guanine nucleotide exchange factor)によって活性化され,GAP(GTPase-activating protein)であるARHGAP10によって不活性化されることが報告されている(図4)13, 15).これらのGEFやGAPの機能不全は各種疾患の原因となることが明らかにされており,ゴルジ体でのCdc42の活性の調節が,細胞機能調節に重要な役割を果たしていることが示唆される.Cdc42がゴルジ体にも細胞膜にも局在していることを先に述べたが,この二つのプールは相互調節関係にあり,ゴルジ体でのCdc42の滞留が細胞膜でのCdc42の活性低下を導き,極性輸送の不全による細胞極性の異常を引き起こすとの仮説が提唱されている(後述)18).
c.微小管とGM130
近年,ゴルジ体が,微小管形成中心(MTOC)として機能し,中心体から生じる微小管と協調して働くことで,ゴルジ体の構造維持やゴルジ体からの極性輸送に必須の役割を果たしていることが明らかとなってきた.ゴルジ体からの微小管の形成は,複数の因子によって誘導されることが報告されている19).たとえば,微小管安定化因子(CLASPs)や微小管架橋因子(MTCL1)がゴルジ体に局在しており,これらが協調して働くことによって微小管形成を誘導するようである19).CALSPsやMTCL1は,いずれもAキナーゼの足場タンパク質であるAKAP450/CG-NAPによってゴルジ体に局在化する19).一方,AKAP450/CG-NAPは,微小管の伸長の核となるγTuRCと直接結合するため,AKAP450/CG-NAPが直接ゴルジ体からの微小管形成を誘導する可能性もある(図4)19).
GM130は,シスゴルジに局在する表在性膜タンパク質でありゴルジ層板の槽間接着や,輸送小胞のゴルジ体への繋留に機能する20).面白いことに,AKAP450/CG-NAPがGM130をターゲットとしてゴルジ体にリクルートされることや(図4),GM130がAKAP450/CG-NAPや腫瘍誘導因子として発見されたPTTG1とともに微小管形成を誘導していることが報告されている19).したがって,GM130がゴルジ体からの微小管形成誘導を調節する主要因子として機能している可能性が示唆される.
一方,AKAP450/CG-NAPがCIP4を介してCdc42をゴルジ体へと誘導することや13, 15),GM130がCdc42の活性化抑制に働くRasGRFと結合することが報告されている18).GM130はRasGRFとともに,ゴルジ体でのCdc42の活性を抑制するとともに,Cdc42を細胞膜へ移行させ,極性輸送を促進しているらしい(図4).また,GM130はRasGRFによるRasの活性化を抑制することも報告されている.さまざまな腫瘍細胞でGM130の減少が観察されていることから,GM130がRasGRFによるCdc42やRasの活性調節を介して,細胞極性の獲得とともに細胞増殖の抑制に機能している可能性が考えられる18).これらの発見は,GM130がCdc42やAKAP450/CG-NAPを介して,小胞輸送経路と微小管やアクチンなどの細胞骨格系を統合的に調節するための足場となっており,細胞増殖や細胞運動の調節に機能している可能性を示唆している.
d.SPCAsとhGAAP
ゴルジ体内腔にはCa2+とMn2+が高濃度に存在しており,特にMn2+は多くの糖転移酵素の活性に必須の因子として知られている.ゴルジ体内腔でのCa2+貯留の意義には不明の点が多いが,ゴルジ体から細胞質へのCa2+の放出が,輸送小胞の形成や,細胞機能調節のシグナルとして機能している可能性が示唆されている21, 22).
SPCAs(SPCA1, SPCA2)は,ゴルジ体に局在するATP依存性のCa2+/Mn2+トランスポーターであり,なかでもSPCA1の変異は,角化細胞の機能不全を誘導し皮膚病を引き起こすことが報告されている21).また,アクチン脱重合タンパク質であるcofilinが,SPCA1と結合してCa2+のTGN内腔への輸送を促進し,積荷のTGNでの選別をサポートしているとの報告がある23).これらのことから,ゴルジ体内腔のCa2+は,TGNでの積荷の選別配送に必須の役割を果たしていることが示唆される.一方,乳がん細胞でSPCA2の発現が上昇していることから,ゴルジ体でのCa2+貯留量やゴルジ体内腔から細胞質へのCa2+流入量(シグナル)の変化が,腫瘍形成に何らかの役割を果たしている可能性も示唆されている21).
最近,ゴルジ体に局在するCa2+チャネルとしてhGAAPが発見された22).hGAAPがゴルジ体からのCa2+放出を制御して細胞接着や細胞運動を調節している可能性が示唆されるが,hGAAPによるCa2+の放出の調節機構やhGAAPとSPCAsとの関係については不明であり,今後の解析が待たれる22).
e.情報伝達系
哺乳類のゴルジ体は,分裂期前期に解体されて細胞質に分散し,終期の核膜再形成とともに再集合するというダイナミックな調節を受けている24).分裂期のゴルジ体の分散は,ゴルジ体を娘細胞に均等に分配するための機構であると考えられてきた.一方,近年の研究から,ゴルジ体の分散が分裂期の進行に必須の役割を果たしていることが明らかとなってきた24).また,ゴルジ体の構造と位置が中心体の位置や運動を制御するとともに,細胞の極性制御に関わることも示唆されている24).したがって,ゴルジ体の細胞内局在や形態が,積極的に細胞の機能の制御に寄与していることが強く示唆される.
一方,ゴルジ体にはERKやPKA, PKD, Myt1などのリン酸化酵素をはじめとして,情報伝達系の因子群が多数局在しており,細胞外からの刺激に応じて活性化することが報告されている25, 26).このことは,ゴルジ体を足場とした情報伝達経路が細胞機能調節に重要な役割を果たしている可能性を強く示唆している.
これらの知見をまとめると,細胞内外からの情報伝達によって,ゴルジ体を足場とした情報伝達系の活性が変化し,ゴルジ体の構造変化やゴルジ体酵素群の機能変化を誘導していることが示唆される.逆にゴルジ体の構造変化やゴルジ体酵素群の機能変化が,ゴルジ体の情報伝達系の活性変化を介して細胞増殖や極性運動,細胞極性の変化などを誘導する可能性が考えられる.すなわち,ゴルジ体の情報伝達系は,ゴルジ体の構造や機能状態と双方向の効果を及ぼしあっていることが示唆される.