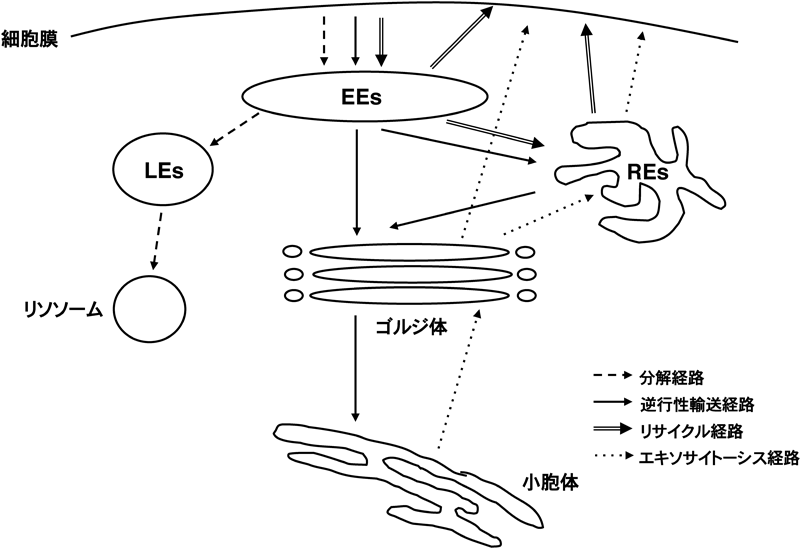
エンドソームは,初期エンドソーム(early endosomes:EEs),後期エンドソーム(late endosomes:LEs),リサイクリングエンドソーム(recycling endosomes:REs)の3種類に大別される.本節では,これら3種類のエンドソームが制御する四つの物質輸送経路(分解経路,リサイクル経路,逆行性輸送経路,エキソサイトーシスとの交差)について概説する.
1)分解経路
細胞膜からエンドサイトーシスにより取り込まれた物質は,まずEEsに輸送される(図1).EEsの“early”は,エンドサイトーシスにより取り込まれた物質が時間的に早期に到達するエンドソームということでつけられている.EEsで物質は分解されるか,または細胞膜へ送り返される(リサイクル)かの選別を受ける1, 2).
分解経路は,EEsからLEsを経由して最終的にリソソームへと至る物質の流れである(図1).リソソームはその内部のpHが強酸性で,酸性環境で活性を持つ多種多様な加水分解酵素を含むオルガネラであり,エンドサイトーシスで取り込まれた物質を分解する.細胞は,この分解経路を使うことによって,細胞外に存在する分子を分解しアミノ酸やコレステロールなどを獲得したり,細胞膜において活性化した増殖因子受容体を分解することで増殖のシグナルが過度に入らないように調節したりしている.増殖因子受容体の分解を制御するいくつかの遺伝子(CblやTsg101など)が,がん遺伝子やがん抑制遺伝子であることは非常に示唆的である.分解経路は,獲得免疫においても重要な機能を有する.MHCクラスII分子は,マクロファージや樹状細胞などの抗原提示細胞に発現している分子である.エンドサイトーシスにより抗原提示細胞に取り込まれた異物タンパク質はリソソームでペプチド断片へと分解される.小胞体で合成されたMHCクラスII分子は,このペプチド断片とエンドソーム・リソソーム内で会合し,次いで細胞膜へと運ばれる.細胞膜に発現したペプチド-MHCクラスII複合体は,ヘルパーT細胞のT細胞抗原受容体に認識され,ヘルパーT細胞を活性化し,異物排除のための免疫応答を開始させる.
K-Rasの変異によりがん化した細胞は,細胞膜が激しく波打っている(ラッフリング)ことが古くから知られている.最近の研究で,ラッフリングとカップリングしたエンドサイトーシス機構(マクロピノサイトーシス)により,がん細胞が細胞外に存在する可溶性アルブミンタンパク質を多量に細胞内に取り込み,次いでリソソームで分解することで,がんの増殖に必要なアミノ酸の補給を行っていることが示された3).K-Rasによるがん化のメカニズムの一端として,エンドサイトーシス・分解経路・栄養供給という新たな視点を与えた研究である.マクロピノサイトーシスに選択的に関与する分子が明らかになることで,新しい種類の抗がん剤の開発につながる可能性が期待される4).
上述したように,EEsは分解に向かう物質とリサイクルに向かう物質の選別(sorting)を行うエンドソームである.この機能に着目して,EEsを選別エンドソーム(sorting endosomes:SEs)と呼んでいる論文も多くある.しかしながら,近年になりREsも物質の選別輸送を行っていることが明らかになり5),SEsという名称は誤解を招く可能性がある.本稿ではEEsに統一して記述する.
2)リサイクル経路
リサイクル経路とは,エンドサイトーシスにより細胞内に取り込まれた分子を,細胞膜/細胞外へ送り返す経路のことである.この経路を使うことによって,細胞膜から取り込まれた受容体が細胞膜上で繰り返し機能することが可能になっている.増殖因子受容体の多くが分解経路にのるのに対し,栄養取得や細胞接着など細胞の恒常的な活動に関わるタンパク質の多くがリサイクル経路を利用している.リサイクル経路には,EEsから細胞膜へ直接戻る経路と,REsを通過してから細胞膜へ戻る二つの経路が知られている(図1).細胞膜へ戻るのに要する時間から,前者をfast recycling経路,後者をslow recycling経路と区別することがある.REsは多くの細胞において核の近縁部に存在し,その内部のpHは6.5と弱酸性である6).
トランスフェリン(transferrin:Tfn)は血清糖タンパク質であり,組織へ鉄を供給している.鉄をキレートした血中のTfnは,細胞膜に存在するTfn受容体に捕捉され,EEsへと輸送される.EEsの弱酸性下で鉄はTfnから遊離し,生じた遊離鉄は次いで細胞質へトランスポートされ,鉄を補因子として利用するタンパク質に組み込まれる.鉄を失ったTfn・Tfn受容体複合体は細胞膜へリサイクルされるが,両者の結合は中性で弱く速やかに解離する.このことにより,Tfnが結合していないTfn受容体が細胞膜に生じ,鉄をキレートしたTfnの取り込みを再度行うことが可能になる.Tfn受容体の半減期は約10日と長く,slow recyclingの1回のプロセスが30分程度であることを考えると,受容体が老化して分解を受けるまでに,500回以上は鉄を取り込むサイクルに使用されていると見積られる.
細胞がfast recyclingとslow recyclingの二つのリサイクル経路を有する生物学的意義については明確ではないが,グルコーストランスポーターGlut4の細胞内輸送は示唆的である7).Glut4は定常時にはGlut4 storage vesicles(GSV)という細胞内コンパートメントに局在しているが,インスリン刺激により速やかに細胞膜へ移行し,細胞内へのグルコースの取り込みを行う.Glut4は次いで細胞膜からGSVへと移行し次のインスリン刺激に備えるが,GSVへの移行にREs通過の必要性が示されている.すなわち,Glut4はslow recycling経路(細胞膜→EEs→REs)を利用してGSVへ輸送されている.抗利尿ホルモン刺激によって細胞膜と細胞内コンパートメントを行き来する水チャンネルaquaporin2についても,細胞膜からホルモン感受性の細胞内コンパートメントへの移行にREs通過の必要性が示唆されている8).
3)逆行性輸送経路
逆行性輸送経路(retrograde transport)とは,エンドサイトーシスにより細胞内に取り込まれた分子を,ゴルジ体/小胞体へ運搬する経路のことである(図1).エキソサイトーシス(ゴルジ体から細胞膜へ至る物質の流れ)と逆の方向性を持った物質の流れであることから,この名称がついている9).
Wntless(ショウジョウバエ)/MIG-14(線虫)は,形態形成決定因子Wntを細胞外へ放出するために必要なWntの細胞内受容体である.Wntlessは,エキソサイトーシスと逆行性輸送を利用することで,ゴルジ体と細胞膜の間を巡回している.レトロマー(retromer)はEEsに局在するタンパク質複合体である.この複合体の働きが抑制されると,Wntlessの逆行性輸送が阻害されてWntlessがゴルジ体に戻れなくなること,そしてWntの細胞外への放出が阻害されることが明らかになった10–14).すなわち,Wntlessは,逆行性輸送経路によりゴルジ体へ送り返され,Wntの細胞外への放出(ゴルジ体→細胞膜)に繰り返し利用されているのである.
レトロマーがEEsに局在することから,レトロマーが同定された当初は,逆行性輸送経路はEEsから直接ゴルジ体に至る経路と考えられてきた.しかしながら最近になって,REsを介した逆行性輸送経路の存在が明らかになってきた.コレラ毒素やシガ毒素などのタンパク質性の毒素は,エンドサイトーシスで細胞へ取り込まれたのち逆行性輸送経路を利用してゴルジ体/小胞体へ到達し,次いで細胞質へ移行して毒性を発揮する15).我々は,REsに局在するタンパク質evectin-2のノックダウンによって,コレラ毒素の輸送がREsで遅延しゴルジ体への到達が劇的に妨げられること,また,Wntlessと同様に,逆行性輸送を使うことによりゴルジ体局在を維持しているタンパク質(TGN46およびGP73)のゴルジ体局在が失われることを示した5).このことは,コレラ毒素,TGN46, GP73の逆行性輸送にREsが必要であることを示している.また最近,REsに局在するTOCA/CDC-42/PAR/WAVEという4分子が,Wntlessの逆行性輸送に必要であることも線虫の系で報告された16).すなわち,EEsからゴルジ体へ直接運搬されると考えられてきたWntlessに関しても,REsを通過してからゴルジ体に運搬されていることが示唆された.
4)エキソサイトーシスとの交差
エキソサイトーシスは“小胞体→ゴルジ体→細胞膜”という,細胞内から細胞外への物質の輸送経路である.ところがここ10年,“小胞体→ゴルジ体→REs→細胞膜”というREsを介したエキソサイトーシス経路が存在することが明らかにされてきた(図1).
2004年にAngらは,水疱性口内炎ウイルス(VSV)のエンベロープタンパク質VSV-Gのゴルジ体からのエキソサイトーシスをライブセルイメージングにより解析し,VSV-Gがゴルジ体を出た数分後にTfn陽性のREsに移動することを見いだした17).さらに,Tfn-HRP/DAB/H2O2処理によりREsを不活性化すると,VSV-Gの細胞膜への輸送が劇的に低下することを示した.このことからVSV-Gの細胞膜へのエキソサイトーシスに,REsを通過することが必要であることが示唆された.2004年以降,REsを経由して細胞膜へ輸送されることが示されたタンパク質の数は増え続けている18).代表的なタンパク質に,細胞接着因子E-cadherin,サイトカインTNFα,低分子量Gタンパク質H-,N-Rasなどがあげられる.
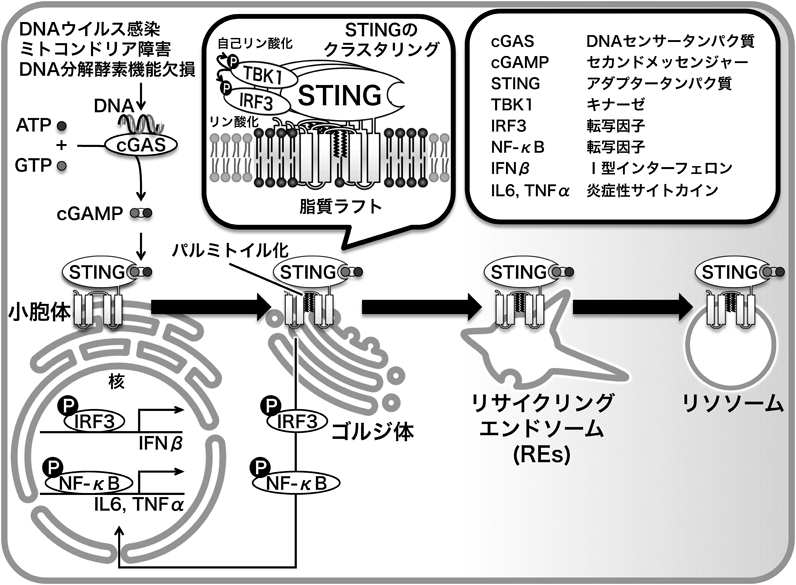
自然免疫応答において,細胞質に露出したDNA(ウイルス/ミトコンドリア/自己ゲノム由来)を異物として感知するセンサータンパク質cGAS(cyclic GMP–AMP synthase),およびアダプタータンパク質STING(stimulator of interferon genes)が同定され,cGAS-STING経路の重要性が明らかとなってきている19).cGASはDNAとの結合によって活性化され,ATPとGTPからcyclic GMP–AMP(cGAMP)を生成する.cGAMPは小胞体局在の4回膜貫通型タンパク質STINGに結合し,その下流でTBK1(キナーゼ)/IRF3(転写因子)を介してI型IFNを,NF-κBを介して炎症性サイトカインを発現誘導する.興味深いことに,cGAS結合後STINGはその細胞内局在を小胞体から変化させるが,その局在変化の意義は不明であった.最近,我々はDNA刺激後のSTINGの細胞内動態を観察することで,STINGが“小胞体→ゴルジ体→REs→p62陽性コンパートメント/リソソーム”と逐次移動していくこと,ゴルジ体でTBK1を活性化していること20)(図2),リソソームの機能阻害によりSTINGの分解が顕著に抑制されること,などを見いだしている.すなわち,STINGは小胞体からエキソサイトーシス経路にのってゴルジ体へ運搬され活性化するが,その不活性化は,ゴルジ体→REs→リソソームというエンドソームを介したリソソームへの物質輸送経路により行われていることが明らかになった.
REs→リソソームという輸送経路については,これまでにほとんど知見がなく,まだ特定の名称もついていない.松井らは,低分子量Gタンパク質Rab12がREsに局在することを見いだし,Rab12のノックダウンがTfn受容体の分解を抑制することを見いだした21).また,Rab12のノックダウンはEGF受容体の分解やTfnのリサイクルには影響を与えなかった.このことから,Rab12はREs→リソソーム経路を制御するREsタンパク質であると示唆されている.
2. REsの物流を制御するホスファチジルセリン(phosphatidylserine:PS)
1)PS結合タンパク質evectin-2
ホスホイノシチドは,ホスファチジルイノシトール(PI)のイノシトール環のヒドロキシ基にリン酸基がエステル結合した,陰性電荷を持つリン脂質である.ホスホイノシチドはそのリン酸基の数と位置によって分類され,現在までにPI(3)P,PI(4)P,PI(5)P,PI(3,4)P2,PI(3,5)P2,PI(4,5)P2,PI(3,4,5)P3の7種類が知られている.近年になり,ホスホイノシチド選択的な可視化プローブの開発により,ホスホイノシチドがオルガネラ膜選択的に局在することが明らかになった22).細胞膜のPI(4,5)P2/PI(3,4,5)P3,EEsのPI(3)P,LEsのPI(3,5)P2がその例である.これらホスホイノシチドは,細胞質に存在する特異的な結合タンパク質をオルガネラ膜上にリクルートし,そのタンパク質の機能を介してオルガネラ固有の機能発現を可能にしている.
PSは極性頭部にセリン残基を持つリン脂質である.真核細胞の生体膜の5~10%を構成し,特に細胞膜の細胞質側に濃縮して存在することが知られている.近年,GrinsteinらはLactadherinタンパク質のC2ドメインを利用したPSの可視化プローブ(LactC2-GFP)を開発した23).LactC2-GFPを細胞質中に発現することによって細胞膜およびオルガネラの細胞質側のPSの検出を試みたところ,小胞体,ゴルジ体,ミトコンドリアなどPSの合成/代謝/運搬に関与しているオルガネラでPSの局在を認めず,その一方でエンドソームと細胞膜に強いPSの局在を認めている.Partonらは,リコンビナントのLactC2-GFPタンパク質を用いることによって細胞固定後のPS染色を行い,細胞内PSの分布を検討した24).この方法ではオルガネラ膜のトポロジーと関係なくPSを検出することができる.その結果,小胞体,ゴルジ体,ミトコンドリアにもPSが検出されたことから,PSはこれら三つのオルガネラではその内腔側に主に存在するのだろうと議論している.エンドソームに関しては,EEs, LEs, REsにPSの局在を認めているが,その中でも特にREsに強い局在を認めている.
evectin-2は,N末端にPHドメイン(pleckstrin homology domain)を,C末端に膜貫通領域を持つ約220アミノ酸から構成されるタンパク質である.PHドメインは100~120アミノ酸からなり,ホスホイノシチドを好んで認識する.我々は,(i)evectin-2がREsに局在すること,(ii)evectin-2 PHドメインがホスホイノシチドを認識せず,その一方でPSを認識すること,(iii)REsの細胞質側に豊富に存在するPSをevectin-2 PHドメインが認識することでevectin-2がREsに局在することを明らかにした5).REsの細胞質側にPSが豊富に存在する,というこの結果は,LactC2-GFPを用いた先の報告24)と一致する.現在,evectin-2のPHドメインはその非常に高いPS特異性が評価され,REsの研究にとどまらず,細胞膜におけるPSの動態観察などにも幅広く利用されている25).
2)evectin-2によるREsからの逆行性輸送制御
我々は,evectin-2のノックダウンにより,コレラ毒素の逆行性輸送がREsで遅延しゴルジ体への到達が妨げられること,また逆行性輸送を使うことによりゴルジ体局在を維持しているタンパク質(TGN46およびGP73)のゴルジ体局在が完全に失われることを見いだした5).その一方で,興味深いことにevectin-2のノックダウンはREsから細胞膜へ戻るTfnのリサイクル経路には影響を及ぼさなかった.すなわち,evectin-2はREsからゴルジ体へ向かう逆行性輸送経路の特異的な制御因子であることが示唆された.この結果は,REsが物質の選別輸送(ゴルジ体への逆行性輸送と細胞膜へのリサイクル輸送)を行っているエンドソームであることを明確に示したものである.
我々はevectin-2の作用メカニズムを解析する中で,低分子量Gタンパク質Arf1のGAP(GTPase activating protein)であるSMAP2のREsへの局在がevectin-2に依存していることを見いだした26).SMAP2のノックダウンは,evectin-2と同様にコレラ毒素の輸送をREsにおいて著しく遅延させるが,Tfnのリサイクルには影響を及ぼさない26).SMAP2がクラスリン結合モチーフを有していることから,クラスリン,クラスリンアダプタータンパク質の関与をさらに解析したところ,REsにクラスリンとAP-1アダプタータンパク質が存在すること,またこれらタンパク質もコレラ毒素の逆行性輸送に必要であることが明らかになった27).
3)REsに局在するPSフリッパーゼによる物流制御—神経変性疾患CAMRQへの関与
真核生物の生体膜のリン脂質は,脂質二重膜間で均等に分布しているのではなく,表側の脂質層と裏側の脂質層とで構成成分が異なる,すなわち非対称的に分布していることが知られている.細胞膜においてこのリン脂質の非対称分布はよく研究されており,PSが細胞質側の脂質層に豊富に存在する一方で,ホスファチジルコリンやスフィンゴミエリンなどのリン脂質は細胞外側の脂質層に豊富に存在する28).オルガネラ膜においてホスホイノシチドは細胞質側の層に限定して存在する.またPSにも非対称分布の存在が示唆されている.
リン脂質の脂質二重膜間での非対称分布の形成に重要な役割を果たしている分子として“フリッパーゼ(flippase)”と呼ばれる酵素が知られている.フリッパーゼは,リン脂質を細胞外側(オルガネラでは内腔側)の脂質層から細胞質側の脂質層へと動かすことができる.
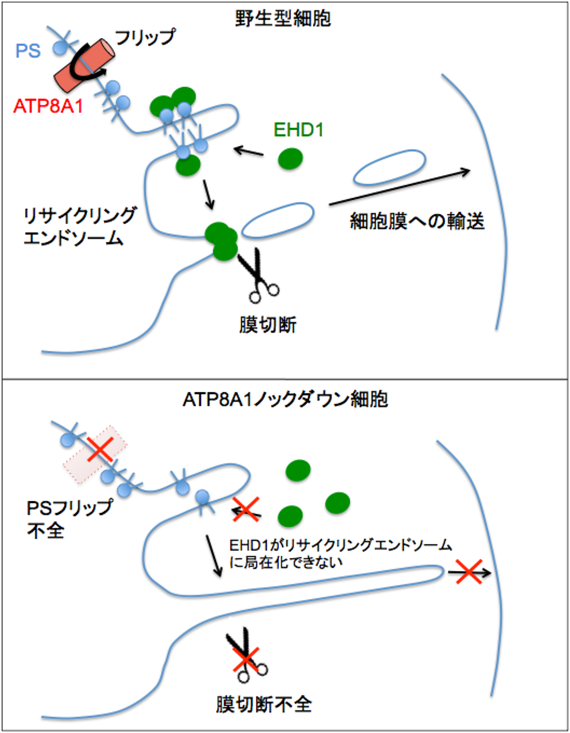
REsの細胞質側にPSが豊富に存在していることから,我々は,リン脂質フリッパーゼのREs局在を予想し解析を行った.その結果,リン脂質フリッパーゼの一つであるATP8A1がREsに局在することを見いだした29).さらに,ATP8A1をノックダウンするとREsにおけるPSの非対称分布が破綻すること,REsからの輸送(リサイクルおよび逆行性輸送)が抑制されること,EHD1タンパク質のREs局在が失われることを見いだした.EHD1は,膜切断活性を有しREsからの輸送を制御するATPaseである.またEHD1はPSに結合することができる.これらの結果から,図3に示すモデルが考えられた:(1)ATP8A1がPSをREsの細胞質側脂質層へフリップする,(2)フリップされたPSによってEHD1がREsへリクルートされる,(3)EHD1が膜切断を行い,REsからの輸送小胞を形成する.
2013年に,ヒトATP8A2(ATP8A1と相同性が非常に高い分子)の点変異が神経系疾患の発症の原因となりうることが報告された30).この疾患はCerebellar ataxia, mental retardation and dysequilibrium syndrome(CAMRQ)と呼ばれ,脳の萎縮や運動障害および精神遅滞を呈する常染色体劣性遺伝の疾患である.この変異型ATP8A2(I376M)は,in vitroでATPase活性およびフリッパーゼ活性を欠失していた29).ATP8A1をノックダウンした細胞に野生型ATP8A2を導入すると,EHD1のREs局在は回復するが,変異型ATP8A2(I376M)では回復しなかった29).すなわち,ATP8A2はREsからの物質輸送を制御しうるPSフリッパーゼであり,CAMRQ変異型ATP8A2ではその能力を欠損していることが示唆された.また,ATP8A2ノックアウトマウスの初代神経細胞で実験を行ったところ,Tfn受容体の総量そのものは野生型の細胞と比較して差が認められないものの,細胞表面のTfn受容体の量は半分以下まで減少していた29).ATP8A2の変異によるCAMRQ発症の原因として,REsを経由する物流の異常が示唆された.
1)REsと自然免疫
自然免疫は先天的に備わった免疫であり,微生物などに固有の分子パターンを異物とし認識し発動する.従来,獲得免疫の補助的な役割を果たすにすぎないと考えられていたが,感染に際して初めに起こる自然免疫の発動がなくては獲得免疫も始動しないことが明らかになり注目されている.
ショウジョウバエのToll/TLR(Toll-like receptor)の発見を端緒にして,CLR(C-type lectin receptor),NLR(NOD-like receptor),RLR(RIG-I-like receptor),STINGなどの自然免疫センサーが発見され,機能解析が進んでいる.TLRとCLRは膜タンパク質であり,細胞外領域(オルガネラの内腔領域)に異物認識部位を有する.NLRとRLRは細胞質性のタンパク質であり,細胞質内に出現する異物を認識して活性化する.STINGについては前節で述べたように,膜貫通タンパク質であり,細胞質のcGAMPに結合して活性化する.これら自然免疫センサーは共通して細胞質に存在するアダプタータンパク質を介してそれぞれのシグナル伝達経路を活性化し,インターフェロン応答や炎症性サイトカインの産生などを引き起こす.異物を認識するこれら自然免疫受容体の働きにより,細胞は異物を速やかに排除することができる.
分解経路に位置するオルガネラ(LEsおよびリソソーム)は,いくつかの自然免疫受容体の活性化に重要である.たとえば,核酸受容体であるTLR7やTLR9はLEs・リソソームに局在し,エンドサイトーシスにより細胞外から取り込まれた核酸,またはこれらエンドソームの酸性条件で変性した細菌やウイルスから漏出する核酸に結合して活性化する.これら分解経路に位置するオルガネラに加えて,最近になりREsも自然免疫応答に重要な機能を果たしていることが明らかになってきた.
Rab11はREsに局在する低分子量Gタンパク質である.Rab11aとRab11bの2種類のアイソフォームが知られており,Rab11aの解析が進んでいる.Gaoらは腸上皮特異的なRab11aノックアウトを作出し表現型解析を行ったところ,自然に腸炎を起こすこと,腸でIL-6などの炎症性サイトカインの発現が上昇していること,およびNF-κBの活性化が起きていることを見いだした31).活性化している遺伝子のプロファイリングから,彼らはTLR9の活性化の可能性を考え検討を行ったところ,(i)野生型とRab11aノックアウトマウスでTLR9の細胞内局在が異なること(ノックアウトマウスでTLR9のリソソーム局在が増加),(ii)LEsに局在する低分子量Gタンパク質Rab7と共沈降するTLR9の量がノックアウトマウスで増加していること,(iii)下流アダプタータンパク質であるMyD88との共沈降実験から,活性化TLR9の量がノックアウトマウスで増加していること,などを見いだした.通常は,リサイクル経路(細胞膜→EEs→REs→細胞膜)にのって不活性化状態で存在しているTLR9が,Rab11aノックアウト下では分解系のオルガネラに移行してしまい,TLR9が活性化しやすい状態にあるのではないか,と議論している.REsとLEsの間に直接の輸送経路があるのかどうかは今後の重要な検討課題である.
TLR4はグラム陰性菌に特異的に存在するリポ多糖を認識し,インターフェロン応答を引き起こすのに必要不可欠な分子である.Espevikらは,抗原提示細胞においてTLR4が主にREsに局在していること,大腸菌を貪食して形成されたファゴソームにTLR4が局在移動することを見いだした32).さらに,Rab11aをノックダウンすると,大腸菌を内包するファゴソームへのTLR4の移動が抑制され,インターフェロン応答も抑制されることを見いだした.
このように,自然免疫受容体をREs経由で分解系のオルガネラに運搬することが,自然免疫受容体の分解系のオルガネラでの適切な活性化に重要であることが明らかになってきた.
2)REsと増殖シグナル/がん
上述したように,REsはPSに非常に富むオルガネラである.今までに,我々はevectin-2とEHD1をREsに存在するPS結合タンパク質として同定したが,これら以外にもREsにPS結合タンパク質が存在する可能性を考えた.そこで,PSに選択的なevectin-2 PHドメインを,近年報告されたBioID法33)(基質特異性が低い細菌由来のビオチン化酵素BirAを用い,BirAの近傍に存在するタンパク質のリシン残基をビオチン化する手法)に用いることで,PS近傍に存在するREsタンパク質を同定することにした.その結果,PS近傍に存在する可能性のある約350種類のタンパク質を見いだしたが,その中には,まったく予想外なことに細胞増殖に関係するYAPを含むHippo/YAP関連分子が約20種類含まれていた.
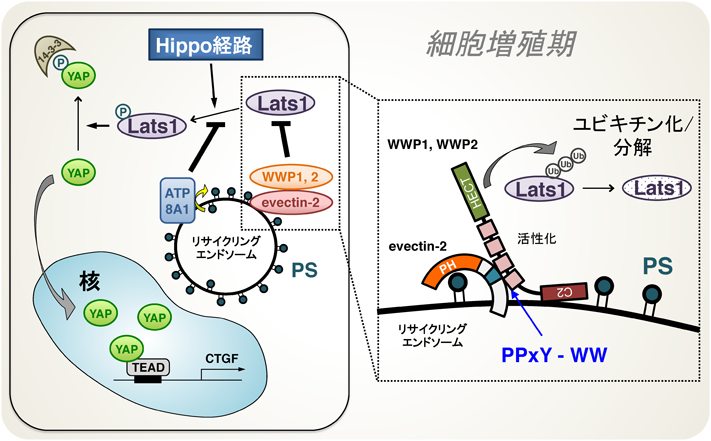
Hippo/YAP経路は,細胞増殖停止期に転写コアクチベーターYAPがリン酸化されることにより核移行が阻止され,逆に細胞増殖期には細胞質中のリン酸化YAPが脱リン酸化されることにより核移行し,細胞増殖に必要な遺伝子群の転写を上げるという,細胞増殖のon/offを担う重要な経路である.YAPがPS近傍タンパク質として同定されたことから,細胞増殖期のYAPの局在を検討したところ,核局在に加えてREsにも局在した.PSとYAPとの関連を調べるために,REsの細胞質側のPS量を制御しているATP8A1をノックダウンしたところ,YAPの核およびREs局在がともに失われ,リン酸化YAP量が増加し,さらに細胞増殖が抑制された.また,REsにPS依存的に存在するevectin-2が,Hippo経路の中核分子であるLats1(YAPのリン酸化酵素)の量を負に制御していることも見いだした.この過程には,evectin-2に結合するNedd4 E3リガーゼ(Itch, WWP1, WWP2)が関与していることも明らかにしている.
これらの結果から,REsの細胞質側のPSは,Hippo経路を抑制することによりYAPの活性化(非リン酸化)に関与していることが示唆された34)(図4).evectin-2に結合するNedd4 E3リガーゼ(Itch, WWP1, WWP2)のうちWWP1はがん遺伝子である.REs/PSによるWWP1の活性化が,細胞のがん化に関与する可能性が示唆される.この結果は,物質輸送以外のREsの機能を初めて明らかにしたものである.
3)PD-L1の細胞膜発現量を規定するリサイクル経路
我々の免疫機構は,外部から侵入した病原体(異物)だけでなく,我々の体から発生したがん細胞に対しても働いている.非自己抗原を細胞膜上に発現しているがん細胞を,活性化した細胞傷害性T細胞が攻撃・排除しているのである.しかしながら,持続的な抗原刺激が起こると,細胞傷害性T細胞の細胞膜上に免疫チェックポイント分子と呼ばれる分子(PD-1など)が発現し,がん細胞の細胞膜上に発現しているPD-L1とPD-1のインタラクションによって,細胞傷害性T細胞の活性が抑制されてしまう(免疫抑制).最近になり,この免疫チェックポイント分子とリガンドとの結合を阻害する免疫チェックポイント阻害剤によるがんの治療が始まった.細胞傷害性T細胞に起きている免疫抑制を解除し,抗腫瘍免疫応答を増強するこの治療法は,すでに一部のがんに対して非常に有効な治療であることが示されている.
今年,これまで機能が知られていなかったCMTM6という膜タンパク質が,がん細胞表面上のPD-L1の発現量を正に制御しているという知見が,二つのグループから同時に報告された35, 36).CMTM6は細胞膜とREsに局在している.CMTM6ノックアウト細胞におけるPD-L1の輸送解析の結果から,細胞膜からエンドサイトーシスで取り込まれたPD-L1の細胞膜へのリサイクル量が減少することで,細胞表面上のPD-L1量が維持できなくなっていると彼らは主張している.また,細胞表面上に発現しているタンパク質のプロファイリングを行ったところ,CMTM6のノックアウトによってその存在量が影響を受けたタンパク質はほとんどなく,CMTM6はPD-L1の非常に選択的な制御因子であることも示している.さらに,B16メラノーマ細胞のマウスへの移植実験で,CMTM6の発現抑制を行ったB16に対して,マウスの生存率が有意に増加することも示した.
この研究は,細胞表面上でのPD-1/PD-L1の結合を阻害することで免疫抑制を解除する現在のがん治療の戦略に加えて,PD-L1のエンドサイトーシス経路に介入することで,がん細胞表面上のPD-L1自体の量を抑制し,免疫抑制を解除できる可能性を示している.新しいタイプの抗がん剤の開発につながることが期待される.
ここ10年,細胞内タンパク質の可視化,分子細胞生物学的アプローチにおける技術革新などがあり,エンドソームが形成する物流ネットワークを制御する重要因子が次々と明らかにされてきた.さらに,これら制御因子のノックアウト実験により,個体・組織レベルでの意義も明らかになってきている.まさにエンドソーム研究は,円熟のときをむかえているといってよいだろう.疾患との関連も,これからますます明らかになってくるものと期待される.
2000年以前には,分解経路とリサイクル経路という二つの経路で理解されていたエンドサイトーシス経路であるが,実は想像以上に複雑であった.エンドサイトーシス経路がエキサイサイトーシスのオルガネラであるゴルジ体とREsを介してリンクしていること,リサイクル経路に位置するREsが分解経路と密接な関係を有していること,などである.これら新しいエンドソーム輸送経路の制御因子を明らかにし,組織・個体における役割を理解していくことは,エンドソーム研究の重要な課題の一つである.
近年,自然免疫におけるエンドソームの重要性が明らかになってきた.エンドソームは感染源に直接対峙する細胞の砦であり,自然免疫とエンドソームは密接な関係にある.エンドソーム輸送経路の分子レベルでのさらなる理解が,自然免疫の破綻によって引き起こされる数多くの炎症性疾患に対する創薬につながることを期待して,本稿を終えたい.