リソソームは,酸性に保たれた細胞内オルガネラの一つであり,複合糖質や脂質などの細胞内基質の分解に関わっている.リソソーム内部には酸性pH条件下で働く種々の加水分解酵素(リソソーム酵素)が存在し,エンドサイトーシスやオートファジーにより細胞内外から取り込まれた生体分子を加水分解する.分解されて生成したアミノ酸,糖そして脂質は再利用される.このことから,リソソームは細胞内の「リサイクル工場」であるといえる.
本稿では,まずリソソームの生合成やオートファジーといった生理機能における制御機構について述べ,次にリソソーム酵素欠損症について,最近の知見も含めて病態解析および治療法をまとめ,中枢神経症状を惹起するリソソーム病を理解するための一助としたい.
リソソームの生合成には,いくつかのモデルが存在するが,後期エンドソームとリソソームが融合と解離を繰り返して膜成分などを分配し,リソソームへと成熟するモデルが有力である1).リソソーム酵素を含む可溶性のリソソームタンパク質は,生合成経路およびエンドサイトーシス経路を介してリソソームに輸送される.小胞体で合成されたリソソーム酵素などの可溶性タンパク質は,ゴルジ体に局在するN-アセチルグルコサミン(GlcNAc)-1-リン酸転移酵素(N-acetylglucosamine-1-phosphate transferase)およびGlcNAc-1-リン酸ジエステル-GlcNAc分解酵素(N-acetylglucosamine-1-phosphodiester-N-acetylglucosaminidase)によりN型糖鎖の非還元末端にマンノース6-リン酸(mannose 6-phosphate:M6P)が付加され,トランスゴルジ体でM6P受容体と結合して,小胞輸送される2).その後,後期エンドソームと融合し,pHが酸性になるとM6P受容体からリソソーム酵素が解離し,リソソームへ輸送される.一方,リソソーム膜タンパク質などはM6P非依存的な局在化機構により小胞輸送を経てリソソームへと運ばれることが知られている.
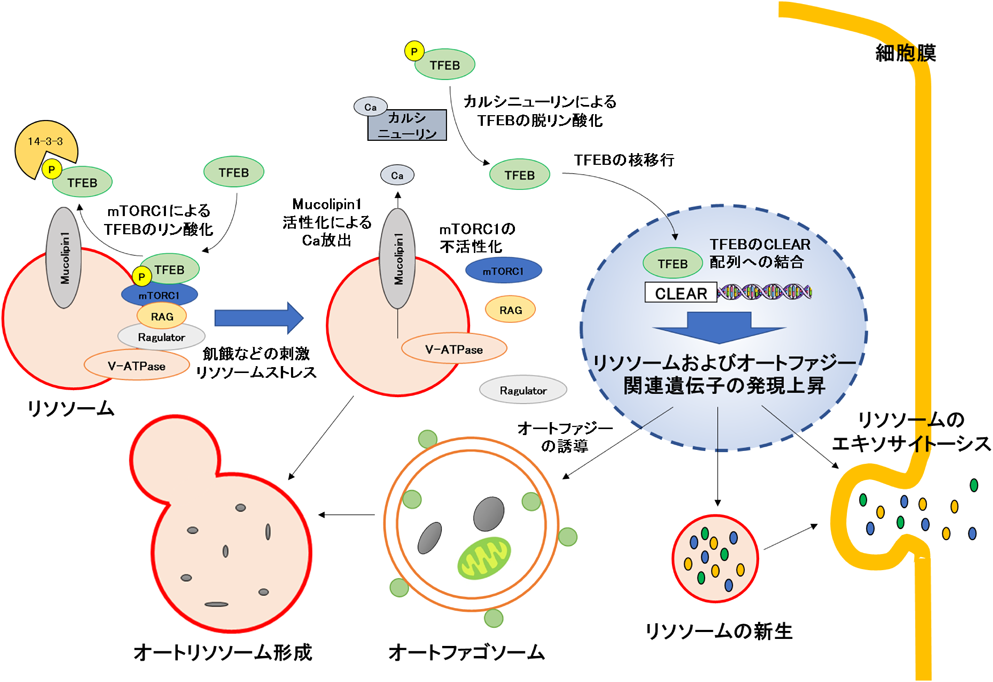
近年,リソソームの生合成においてマスター遺伝子が存在することが発見された.transcription factor EB(TFEB)は,塩基性ヘリックスループヘリックス-ロイシンジッパー型の転写因子であるMiT/TFEサブファミリーの一つであり,E-box配列(CANNTG)に結合することが知られている.2009年にイタリア・ナポリにあるテレソン遺伝医学研究所(Telethon Institute of Genetics and Medicine:TIGEM)のAndrea Ballbio博士のグループは,バイオインフォマティクス解析により,多くのリソソーム関連遺伝子のプロモーター領域にcoordinated lysosomal expression and regulation(CLEAR)配列と呼ばれる共通配列(GTC ACG TGA C)があり,TFEBが結合することを明らかにした3, 4).TFEBを過剰発現させた細胞では,リソソーム酵素や膜タンパク質の遺伝子発現が同時に上昇し,リソソームの数も増大することが明らかにされている.通常,TFEBはリン酸化されており,14-3-3タンパク質と結合して細胞質に局在している.このリン酸化に関与するキナーゼとしてmTORC1およびERKが同定されている5).一方でTFEBの脱リン酸化にはカルシニューリンが関わっていることが報告された.飢餓状態などのさまざまな刺激によりTFEBの脱リン酸化が起こると,14-3-3タンパク質が解離して,TFEBは核に移行してCLEAR配列を持つプロモーター領域に結合してリソソーム関連遺伝子を同時に発現上昇させる6)(図1).また,TFEBの活性化は,オートファジー7)やリソソームのエキソサイトーシス8)を引き起こすことが報告され,その生理機能だけなく病態への寄与が注目されており,治療標的として期待されている.
リソソームの重要な生理機能の一つにオートファジーがある.オートファジーは,飢餓状態などで誘導され,細胞内の自己タンパク質などをリソソームで分解することで栄養源を確保する生理作用である9).また,通常の環境下でもプロテアソーム経路と並び,細胞成分の代謝に働いている.近年,オートファジーが発がん10),神経変性疾患11, 12),2型糖尿病等の生活習慣病13),感染症14),各種の炎症など,さまざまな疾患の発症・進展に関与していることが報告されている.また,発生・分化,老化,免疫などの重要な生理機能を持つことが明らかになり,オートファジー研究は大きな発展を遂げ,2016年に大隅良典先生がノーベル賞を受賞された.
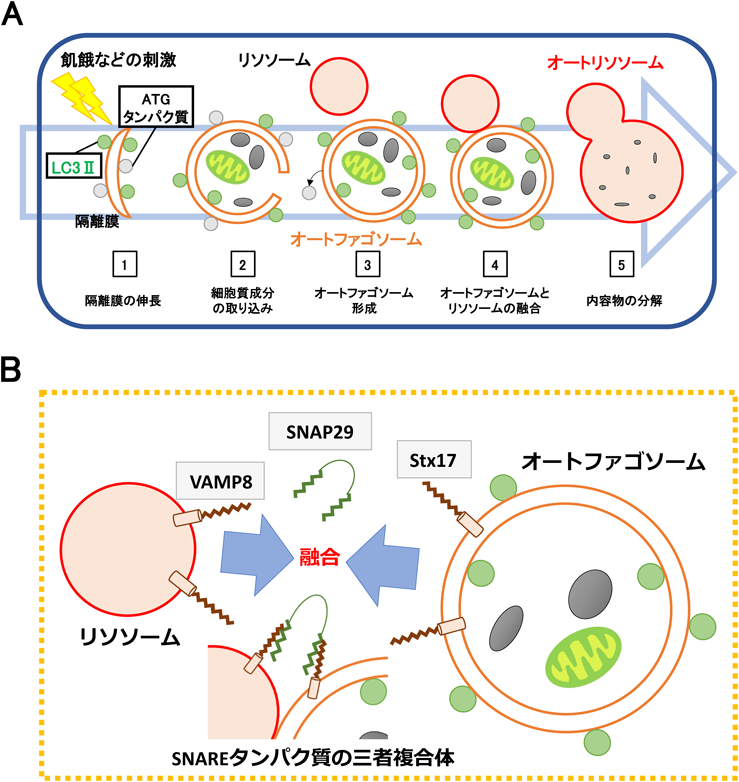
オートファジーにおいてリソソームは自己消化のための加水分解酵素の供給といった役割を演じている.オートファジーが誘導されると,細胞質に隔離膜と呼ばれる扁平な小胞が現れて細胞質を取り込みながら伸長し,その後にオートファゴソームと呼ばれる小胞が形成される15)(図2A).オートファゴソーム内にはミトコンドリアなどのオルガネラも含まれており,リソソームと融合するとリソソーム酵素により分解され,得られたアミノ酸は栄養源として再利用される.リソソームとオートファゴソームが融合した小胞はオートリソソームと呼ばれ,このオートリソソームはチューブ形成を起こした後に多数の小さな小胞となり,成熟後にリソソームとしてまた利用される16).オートリソソームの形成にはsoluble NSF-attachment protein receptor(SNARE)タンパク質が関わっていることが報告されている17).SNAREタンパク質は,融合する小胞膜の両方に局在しており,各SNAREドメインが結合することにより膜融合を誘導する.オートファゴソームにはSyntaxin 17(Stx17)が局在しており,一方でリソソームにはvesicle-associated membrane protein 8(VAMP8)が局在している.オートファジーが誘導されると小胞体から隔離膜が伸長してオートファゴソームが形成され,その後に完成したオートファゴソームの外膜にStx17が局在する.このStx17と細胞質に存在するSNAREタンパク質であるSynaptosomal-associated protein 29(SNAP29),そしてリソソーム膜上のVAMP8の三者複合体が形成されるとオートファゴソームとリソソームの融合が起こり,オートリソソームが形成されることが明らかにされている(図2B).また,SNAP29にO結合したGlcNAcがSNAREの三者複合体形成を調節していることが最近報告された18).このオートリソソーム形成機構はオートファジーにおいて重要なステップであり,病態メカニズムとの関わりを調べることで,オートファジーが関連する疾患に対する新たな治療ターゲットとなることが期待される.
リソソームには数多くのリソソーム酵素および関連タンパク質が存在するが,これらの遺伝子に変異が起こり,酵素活性低下などの機能異常が起こった場合にリソソーム病が発症する.この疾患では,リソソーム酵素などの活性低下により,生理的にリソソームで分解・排出されていた生体内基質が過剰に蓄積する.その結果,全身性に細胞・臓器障害が引き起こされ,さまざまな症状を惹起する先天性代謝異常症が発症する.リソソーム病は,欠損する酵素や蓄積する代謝産物により分類され(表1),現在40種類以上存在し,わが国において「指定難病」とされている.
表1 リソソーム病の分類| 疾患名 | 原因遺伝子 | 欠損する酵素・タンパク質 | 主な蓄積基質 |
|---|
| スフィンゴリピドーシス(糖脂質蓄積症) | | | |
| GM1ガングリオシドーシス | GLB | β-ガラクトシダーゼ | GM1ガングリオシド |
| GM2ガングリオシドーシス(Tay-Sachs病) | HEXA | β-ヘキソサミニダーゼ | GM2ガングリオシド |
| GM2ガングリオシドーシス(Sandhoff病) | HEXB | β-ヘキソサミニダーゼ | GM2ガングリオシド |
| Gaucher病 | GBA | グルコシルセラミダーゼ | グルコセレブロシド |
| Fabry病 | GLA | α-ガラクトシダーゼ | グロボトリアオシルセラミド |
| ムコ多糖症(グリコサミノグリカン蓄積症) | | | |
| MPS I(Hurler/Scheie病) | IDUA | α-イズロニダーゼ | デルマタン硫酸・ヘパラン硫酸 |
| MPS II(Hunter病) | IDS | イズロネート・スルファターゼ | デルマタン硫酸・ヘパラン硫酸 |
| MPS IIIA(SanfilippoA病) | SGSH | ヘパラン-N-スルファターゼ | ヘパラン硫酸 |
| MPS IVB(Morquio病) | GLB | β-ガラクトシダーゼ | ケラタン硫酸 |
| MPS VII(Sly病) | GUSB | β-グルクロニダーゼ | デルマタン硫酸・ヘパラン硫酸 |
| 糖タンパク質分解異常症(オリゴ糖蓄積症) | | | |
| α-マンノシドーシス | MAN2B1 | α-マンノシダーゼ | α-マンノース含有オリゴ糖 |
| α-フコシドーシス | FUCA1 | α-フコシシダーゼ | α-フコース含有オリゴ糖 |
| シアリドーシス | NEU1 | ノイラミニダーゼ1 | シアル酸含有オリゴ糖 |
| ガラクトシアリドーシス | CTSA | カテプシンA | シアル酸含有オリゴ糖 |
| アスパラチルグルコサミン尿症 | AGA | アルパラチルグルコサミニダーゼ | アスパラチルグルコサミン |
| 糖原病(グリコーゲン蓄積症) | | | |
| Pompe病 | GAA | 酸性α-グルコシダーゼ | グリコーゲン |
| 中性脂質蓄積症 | | | |
| Wolman病 | LIPA | 酸性リパーゼ | コレステリルエステルおよびトリグリセリド |
| その他 | | | |
| GM2活性化タンパク質欠損症 | GM2A | GM2活性化タンパク質 | GM2ガングリオシド |
| サポシンB欠損症 | SAP1 | サポシンB | スルファチド |
| I-細胞病(ムコリピドーシスII) | GNPTAB | GlcNAc-1-リン酸転移酵素 | 脂質,グリコサミノグリカンなど |
1)スフィンゴリピドーシス
セラミドに糖が結合した複合糖質であるスフィンゴ糖脂質の分解代謝に関与するリソソーム酵素遺伝子の変異により,リソソームにスフィンゴ糖脂質が過剰蓄積して発症する.特徴として,ガングリオシドやその関連糖脂質が患者の臓器内に進行性に蓄積し,精神運動発達遅延,顔貌異常,骨異常,肝脾腫などの全身症状を示す.
2)ムコ多糖症
硫酸基が付加した2糖の繰り返し構造からなるグリコサミノグリカン分解に関わるリソソーム酵素の欠損により発症する.欠損する酵素の種類に応じて,特異的なグリコサミノグリカンが組織中に蓄積し,尿中に分泌される.ムコ多糖症の臨床症状は多様であるが,多くの患者は,粗な顔貌,多発性骨異常や内臓腫大を伴う.また,聴力低下,視力障害,心血管障害や精神発達の遅れを伴う場合がある.
3)オリゴ糖蓄積症
糖タンパク質糖鎖の分解代謝に関係するリソソーム酵素の活性低下が起こると,オリゴ糖の蓄積症を発症する.臨床症状には神経障害,粗な顔貌や多発性骨異常が含まれる.
4)糖原病
糖原病II型(Pompe病)は,酸性α-グルコシダーゼの活性低下により,リソソーム内でのグリコーゲン分解が障害され,蓄積して発症する.症状として,心拡大,巨舌や筋力低下などが特徴である.
5)中性脂質蓄積症
酸性リパーゼの活性低下は,コレステリルエステルとトリグリセリドの蓄積を惹起する.遺伝性の酸性リパーゼ欠損症には,臨床的に異なる2種類の疾患であるWolman病とコレステリルエステル蓄積症が含まれる.前者では,肝脾腫,脂肪便や副腎石灰化などの症状が出現する.後者は,それよりも緩徐で軽い臨床経過をとる.
6)その他
リソソーム酵素はM6P受容体を介して,ゴルジ体からエンドソーム/リソソームへと輸送される.リソソーム酵素であるGlcNAc-1-リン酸転移酵素は,リソソーム酵素上のM6P認識マーカーの合成における第1段階に関係する酵素である.この酵素の異常により,I-細胞病(ムコリピドーシスII)が発症する.この疾患では,早期発症で重度の精神運動発達遅延,粗な顔貌や多発性骨異常を伴う.また,スフィンゴ糖脂質のリソソームでの分解には,スフィンゴ糖脂質活性化タンパク質が必要である.現在までに,4種類のスフィンゴ糖脂質活性化タンパク質欠損症が報告されている.
我々はこれまで中枢神経症状を惹起する代表的なリソソーム病であるGM2ガングリオシドーシスについて,病態解析および治療法開発を行ってきた.GM2ガングリオシドーシスは,リソソーム酵素であるβ-ヘキソサミニダーゼ(β-hexosaminidase:Hex)の遺伝的欠損により,糖脂質のGM2ガングリオシド(GM2)が主に神経細胞に過剰に蓄積し,それに伴って中枢神経症状などを呈するスフィンゴリピドーシスの一つである19).GM2の分解に関与する遺伝子には,HEXA, HEXB,およびGM2Aの3種があり,それぞれがHexのα鎖,β鎖およびGM2アクチベータータンパク質をコードしている.Hexのα鎖とβ鎖はそれぞれ会合して二量体を形成するが,αβヘテロ二量体であるHexAのみがGM2アクチベータータンパク質と協同してGM2を分解することができる.これによりα鎖,β鎖およびGM2アクチベータータンパク質のいずれが欠損してもGM2ガングリオシドーシスとなり,それぞれHEXA, HEXBおよびGM2A遺伝子の変異に基づく常染色体劣性遺伝病であるTay-Sachs病(TSD),Sandhoff病およびAB型Tay-Sachs病が発症する.
1995年にマウスHex β鎖遺伝子(Hexb)のノックアウト(KO)マウス(Sandhoff病モデルマウス:SDマウス)が作製され,きわめてヒトと類似した病態を示すことが明らかにされ,病態解析や治療モデルとして利用されている20).このマウスでは発達に伴い,脳ではGM2を含む生体内基質が進行性に蓄積する.生後2か月ごろまでは明らかな症状は認めないが,次第に動きが鈍くなり,振戦,驚愕反応,歩行障害を認め,4か月で死亡する.生体内基質の蓄積と神経変性等との関係については依然として不明の点が多く,SDマウスを用いた研究はGM2ガングリオシドーシスの病態解明・治療法開発にとって重要である.
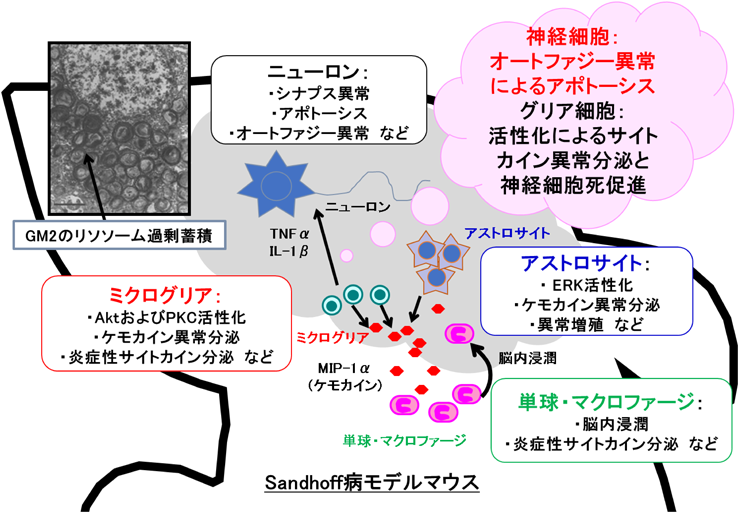
1)リソソーム病モデルマウスの脳におけるグリア細胞活性化
我々はSDマウスの脳において,炎症や病原体感染時に産生され,白血球などの浸潤を惹起する機能を持つケモカインについて発現解析を行い,脳疾患で変動が報告されているケモカインのうち,macrophage inflammatory protein-1α(MIP-1α)のみが症状の進行とともにSDマウスの脳に選択的に増大していることを明らかにした.またMIP-1αを発現している細胞はミクログリアおよびアストロサイトであることを報告している21).これまでSDマウスを含むさまざまな中枢神経症状を伴うリソソーム病のモデルマウスにおいて,グリアの活性化が起こり,神経炎症が起こることが報告されている22, 23).特にMIP-1αは,SDマウスの脳において末梢からの活性化マクロファージの浸潤を増大させることがダブルKOマウスを用いて証明され24),治療効果のマーカーとしても利用されている25, 26).また,我々はSDの脳からアストロサイトおよびミクログリアを取り出し,株化に成功している.SDマウス由来ミクログリアでは,PKCおよびAktの活性化によりケモカインの異常産生を起こしていることが明らかとなった27).一方で,アストロサイトではGM2蓄積によりERK活性化が起こっており,異常増殖を起こすことを明らかにした28).これらの成果は,SDマウス脳内において生体内基質蓄積により,グリア細胞内のシグナル伝達異常が起こり,その結果としてグリア細胞の活性化が起こることを示している(図3).しかしながら,近年の他のグループの報告により,炎症性サイトカインやケモカインとSDマウスのダブルKOマウスでは,Hexb単独KOマウス(SDマウス)と比較して寿命が10~40日程度しか延長しないことが明らかとなった24, 29).このことから,SDマウスの脳において,グリアの活性化とそれに伴う炎症性サイトカイン放出による神経炎症は,病態の進展に影響を与えているが,神経細胞死や中枢神経症状については神経細胞自身の病態を調べる必要がある.
2)リソソーム病におけるオートファジー異常
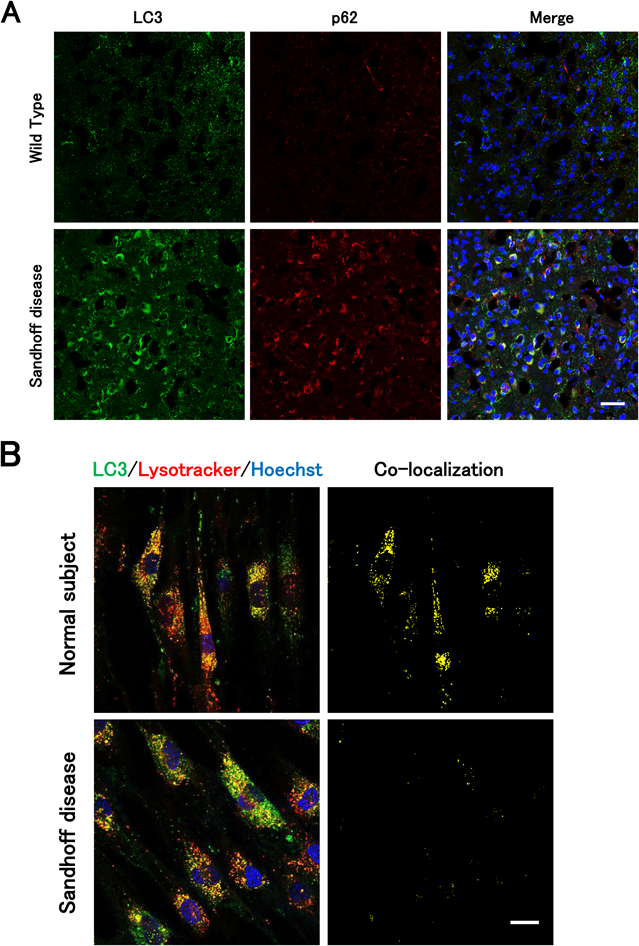
我々はリソソーム病において,リソソーム蓄積がオートファジーにどのような影響を与えるかを調べるために,SDマウスの脳においてオートファゴソームマーカーであるLC3に対する抗体を用いて免疫染色を行った.その結果,野生型マウスでは観察されないLC3免疫反応性がSDマウスの脳において顕著に増大していることが明らかとなった.また,ウェスタンブロット解析においてもオートファゴソーム形成の指標であるLC3IIがSDマウスで増大していた.これらの結果は,これまで報告されている他のリソソーム病での結果と一致していた30).また,オートファジーにより選択的に分解される基質であるp62に対する抗体を用いて免疫染色を行うと,SDマウスの脳において免疫反応性が増大しており,LC3陽性細胞と共染色された(図4A).さらにLC3陽性細胞がどの細胞であるかを調べるために細胞型マーカーを用いて染色を行った結果,ほとんどの細胞がNeuN陽性神経細胞と一致した.このことから,SDマウス脳内ではリソソーム内でのGM2蓄積に伴い,神経細胞においてオートファジーの異常が起こっていることが示唆された.
そこで我々は,Sandhoff病(SD)患者由来線維芽細胞を用い,リソソームとオートファゴソームの融合について調べた.飢餓条件において,正常細胞とSD患者由来細胞に対して,リソソームを染色するLysotrackerとオートファゴソームマーカーであるLC3に対する抗体を用いた免疫蛍光を指標に,オートリソソーム形成を共局在解析により調べた.その結果,正常細胞では全オートファゴソームのうち約65%がリソソームと融合してオートリソソームを形成していたのに対し,SD患者由来細胞では約30%まで低下していた(図4B).この形成率低下は,リソソーム病モデル細胞に対する正常な遺伝子の導入により,正常細胞と同等まで回復したことから,リソソーム酵素欠損に基づく生体内基質蓄積がオートファゴソームとリソソームの融合に影響を与えていることが示唆された.現在,リソソーム病モデル細胞においてSNAREタンパク質の発現や局在に変化があるかどうか調べている.
以上から,リソソーム病の神経細胞では,生体内基質の蓄積により,オートファジーに異常が起こり,結果として神経細胞死を起こしている可能性が高い(図3).オートファゴソームを形成できないマウスでは,α-シヌクレインなどの蓄積が神経細胞で起こり,結果として神経変性を起こすことが知られている11, 12).またアルツハイマー病に関係するβ-アミロイドはオートファジーにより排出されること31)やパーキンソン病におけるミトファジー異常がドパミン神経の細胞死に関与している報告32)からも,オートファジーの異常が神経細胞死において重要な原因の一つであることが考えられる.リソソーム病においても,オートファジー異常の原因や病態との相関を調べることで新たな治療ターゲットの発見につながる可能性があり,今後の研究の進展に期待したい.
現在のところ,GM2ガングリオシドーシスをはじめとする中枢神経症状を惹起するリソソームに対する有効な治療法は確立されていないが,モデル動物を用いる非臨床試験から,複数の疾患に対しては臨床試験が実施されている.最近,神経セロイドリポフスチノーシス2型(NCL2)の責任酵素製剤(tripeptidyl peptidase)の脳室内投与法が米国FDAにより認可された.酵素補充療法は,正常なリソソーム酵素を哺乳類細胞などで大量に発現・精製し,患者に投与する治療法である.これはリソソーム酵素に付加したM6Pと細胞表面に存在するM6P受容体との結合によるエンドサイトーシスによりリソソームまで酵素を輸送させる方法であり33),すでに末梢症状が主であるリソソーム病において臨床応用されている.近年,モデルマウスにおいて脳脊髄液中に酵素を投与する方法が試みられ,一定の治療効果があることが報告されている26).また機能向上を目指した改変も試みられている34).
基質枯渇療法は,N-butyldeoxynojirimycin(NB-DNJ)などの糖転移酵素阻害剤を投与し,糖脂質の生合成を阻害することで治療をはかる方法である.NB-DNJ投与SDマウスでは脳および末梢臓器での糖脂質の蓄積が同週齢のマウスと比較して減少し,症状の進行の遅滞と寿命の延長が起こり35),骨髄移植と基質枯渇療法を組み合わせた治療では約9.5か月まで寿命が延長することが報告されている36).近年,欧米においてGaucher病,Nieman-Pick病C型に対してMiglustatが臨床応用されている.
また,アデノ随伴ウイルスベクターなどを用いて正常な遺伝子を導入する遺伝子治療はさまざまなリソソーム病モデル動物に対して試みられ,一定の治療効果が得られており37),ムコ多糖症1型および2型については臨床試験が進行中である.
最近,我々はTSD患者由来線維芽細胞からiPS細胞を樹立し,分化誘導によって神経細胞を獲得してシグナル解析を行った.その結果,正常神経細胞と比較してmTORC1などの低下が起こっており,オートファジーが誘導されていることが明らかになった.前述したようにリソソーム病ではオートリソソーム形成が抑制されており,シグナル異常がオートファゴソームの蓄積を引き起こすため神経細胞死を促進していることが示唆された.このことから,リソソーム病の神経細胞におけるオートファジー異常やシグナル伝達の異常が新しい治療ターゲットになるかもしれない.
近年,オートファジーをはじめとするリソソーム関連の研究は目覚ましい進歩を遂げている.特にTFEBについては,さまざまな疾患における役割や生理機能が明らかとなってきており,今後大きく発展する可能性がある.リソソーム病における研究についても,TFEBおよびオートファジーに関連した病態解析そして治療法開発の発展に期待したい.
引用文献References
1) Bright, N.A., Gratian, M.J., & Luzio, J.P. (2005) Curr. Biol., 15, 360–365.
2) Cantor, A.B., Baranski, T.J., & Kornfeld, S. (1992) J. Biol. Chem., 267, 23349–23356.
3) Sardiello, M., Palmieri, M., di Ronza, A., Medina, D.L., Valenza, M., Gennarino, V.A., Di Malta, C., Donaudy, F., Embrione, V., Polishchuk, R.S., Banfi, S., Parenti, G., Cattaneo, E., & Ballabio, A. (2009) Science, 325, 473–477.
4) Palmieri, M., Impey, S., Kang, H., di Ronza, A., Pelz, C., Sardiello, M., & Ballabio, A. (2011) Hum. Mol. Genet., 20, 3852–3866.
5) Settembre, C., Zoncu, R., Medina, D.L., Vetrini, F., Erdin, S., Erdin, S., Huynh, T., Ferron, M., Karsenty, G., Vellard, M.C., Facchinetti, V., Sabatini, D.M., & Ballabio, A. (2012) EMBO J., 31, 1095–1108.
6) Medina, D.L., Di Paola, S., Peluso, I., Armani, A., De Stefani, D., Venditti, R., Montefusco, S., Scotto-Rosato, A., Prezioso, C., Forrester, A., Settembre, C., Wang, W., Gao, Q., Xu, H., Sandri, M., Rizzuto, R., De Matteis, M.A., & Ballabio, A. (2015) Nat. Cell Biol., 17, 288–299.
7) Settembre, C., Di Malta, C., Polito, V.A., Garcia Arencibia, M., Vetrini, F., Erdin, S., Erdin, S.U., Huynh, T., Medina, D., Colella, P., Sardiello, M., Rubinsztein, D.C., & Ballabio, A. (2011) Science, 332, 1429–1433.
8) Medina, D.L., Fraldi, A., Bouche, V., Annunziata, F., Mansueto, G., Spampanato, C., Puri, C., Pignata, A., Martina, J.A., Sardiello, M., Palmieri, M., Polishchuk, R., Puertollano, R., & Ballabio, A. (2011) Dev. Cell, 21, 421–430.
9) Mizushima, N. & Komatsu, M. (2011) Cell, 147, 728–741.
10) Mathew, R., Karantza-Wadsworth, V., & White, E. (2007) Nat. Rev. Cancer, 7, 961–967.
11) Komatsu, M., Waguri, S., Chiba, T., Murata, S., Iwata, J., Tanida, I., Ueno, T., Koike, M., Uchiyama, Y., Kominami, E., & Tanaka, K. (2006) Nature, 441, 880–884.
12) Hara, T., Nakamura, K., Matsui, M., Yamamoto, A., Nakahara, Y., Suzuki-Migishima, R., Yokoyama, M., Mishima, K., Saito, I., Okano, H., & Mizushima, N. (2006) Nature, 441, 885–889.
13) Jung, H.S., Chung, K.W., Won Kim, J., Kim, J., Komatsu, M., Tanaka, K., Nguyen, Y.H., Kang, T.M., Yoon, K.H., Kim, J.W., Jeong, Y.T., Han, M.S., Lee, M.K., Kim, K.W., Shin, J., & Lee, M.S. (2008) Cell Metab., 8, 318–324.
14) Levine, B., Mizushima, N., & Virgin, H.W. (2011) Nature, 469, 323–335.
15) Hamasaki, M., Furuta, N., Matsuda, A., Nezu, A., Yamamoto, A., Fujita, N., Oomori, H., Noda, T., Haraguchi, T., Hiraoka, Y., Amano, A., & Yoshimori, T. (2013) Nature, 495, 389–393.
16) Yu, L., McPhee, C.K., Zheng, L., Mardones, G.A., Rong, Y., Peng, J., Mi, N., Zhao, Y., Liu, Z., Wan, F., Hailey, D.W., Oorschot, V., Klumperman, J., Baehrecke, E.H., & Lenardo, M.J. (2010) Nature, 465, 942–946.
17) Itakura, E., Kishi-Itakura, C., & Mizushima, N. (2012) Cell, 151, 1256–1269.
18) Guo, B., Liang, Q., Li, L., Hu, Z., Wu, F., Zhang, P., Ma, Y., Zhao, B., Kovács, A.L., Zhang, Z., Feng, D., Chen, S., & Zhang, H. (2014) Nat. Cell Biol., 16, 1215–1226.
19) Gravel, R.A., Kaback, M.M., Proia, R.L., Sandhoff, K., & Suzuki, K. (2001) The Metabolic and Molecular Bases of Inherited Disease, 8th ed., Scriver, C.R., Beaudet, A.L., Sly, W.S., & Valle, D. (eds.), pp. 3827–3876, McGraw-Hill, New York.
20) Sango, K., Yamanaka, S., Hoffmann, A., Okuda, Y., Grinberg, A., Westphal, H., McDonald, M.P., Crawley, J.N., Sandhoff, K., Suzuki, K., & Proia, R.L. (1995) Nat. Genet., 11, 170–176.
21) Tsuji, D., Kuroki, A., Ishibashi, Y., Itakura, T., Kuwahara, J., Yamanaka, S., & Itoh, K. (2005) J. Neurochem., 92, 1497–1507.
22) Wada, R., Tifft, C.J., & Proia, R.L. (2000) Proc. Natl. Acad. Sci. USA, 97, 10954–10959.
23) Jeyakumar, M., Thomas, R., Elliot-Smith, E., Smith, D.A., van der Spoel, A.C., d’Azzo, A., Perry, V.H., Butters, T.D., Dwek, R.A., & Platt, F.M. (2003) Brain, 126, 974–987.
24) Wu, Y.P. & Proia, R.L. (2004) Proc. Natl. Acad. Sci. USA, 101, 8425–8430.
25) Jeyakumar, M., Lee, J.P., Sibson, N.R., Lowe, J.P., Stuckey, D.J., Tester, K., Fu, G., Newlin, R., Smith, D.A., Snyder, E.Y., & Platt, F.M. (2009) Stem Cells, 27, 2362–2370.
26) Tsuji, D., Akeboshi, H., Matsuoka, K., Yasuoka, H., Miyasaki, E., Kasahara, Y., Kawashima, I., Chiba, Y., Jigami, Y., Taki, T., Sakuraba, H., & Itoh, K. (2011) Ann. Neurol., 69, 691–701.
27) Kawashita, E., Tsuji, D., Kawashima, N., Nakayama, K., Matsuno, H., & Itoh, K. (2009) J. Neurochem., 109, 1215–1224.
28) Kawashima, N., Tsuji, D., Okuda, T., Itoh, K., & Nakayama, K. (2009) J. Neurochem., 111, 1031–1041.
29) Abo-Ouf, H., Hooper, A.W., White, E.J., van Rensburg, H.J., Trigatti, B.L., & Igdoura, S.A. (2013) Hum. Mol. Genet., 22, 3960–3975.
30) Settembre, C., Fraldi, A., Jahreiss, L., Spampanato, C., Venturi, C., Medina, D., de Pablo, R., Tacchetti, C., Rubinsztein, D.C., & Ballabio, A. (2008) Hum. Mol. Genet., 17, 119–129.
31) Yu, W.H., Cuervo, A.M., Kumar, A., Peterhoff, C.M., Schmidt, S.D., Lee, J.H., Mohan, P.S., Mercken, M., Farmery, M.R., Tjernberg, L.O., Jiang, Y., Duff, K., Uchiyama, Y., Näslund, J., Mathews, P.M., Cataldo, A.M., & Nixon, R.A. (2005) J. Cell Biol., 171, 87–98.
32) Vives-Bauza, C., Zhou, C., Huang, Y., Cui, M., de Vries, R.L., Kim, J., May, J., Tocilescu, M.A., Liu, W., Ko, H.S., Magrané, J., Moore, D.J., Dawson, V.L., Grailhe, R., Dawson, T.M., Li, C., Tieu, K., & Przedborski, S. (2010) Proc. Natl. Acad. Sci. USA, 107, 378–383.
33) Schiffmann, R., Kopp, J.B., Austin, H.A. 3rd, Sabnis, S., Moore, D.F., Weibel, T., Balow, J.E., & Brady, R.O. (2001) JAMA, 28, 2743–2749.
34) Kitakaze, K., Mizutani, Y., Sugiyama, E., Tasaki, C., Tsuji, D., Maita, N., Hirokawa, T., Asanuma, D., Kamiya, M., Sato, K., Setou, M., Urano, Y., Togawa, T., Otaka, A., Sakuraba, H., & Itoh, K. (2016) J. Clin. Invest., 126, 1691–1703.
35) Jeyakumar, M., Butters, T.D., Cortina-Borja, M., Hunnam, V., Proia, R.L., Perry, V.H., Dwek, R.A., & Platt, F.M. (1999) Proc. Natl. Acad. Sci. USA, 96, 6388–6393.
36) Jeyakumar, M., Norflus, F., Tifft, C.J., Cortina-Borja, M., Butters, T.D., Proia, R.L., Perry, V.H., Dwek, R.A., & Platt, F.M. (2001) Blood, 97, 327–329.
37) Cachón-González, M.B., Wang, S.Z., Ziegler, R., Cheng, S.H., & Cox, T.M. (2014) Hum. Mol. Genet., 23, 730–748.
著者紹介Author Profile
 辻 大輔(つじ だいすけ)
辻 大輔(つじ だいすけ)徳島大学大学院医歯薬学研究部助教.博士(薬学).
略歴1978年徳島県に生れる.2001年徳島大学薬学部薬学科卒業.03年同大学院薬学研究科博士前期課程修了.05年同薬学研究科博士後期課程修了.同年徳島大学大学院ヘルスバイオサイエンス研究部助手.06年日本生化学会中国・四国支部例会学術奨励賞.07年徳島大学大学院ヘルスバイオサイエンス研究部助教.10年徳島大学若手研究者学長表彰.11年日本薬学会中国四国支部奨励賞.12年日本先天代謝異常学会総会若手優秀演題賞.13年Telethon Institute of Genetics and Medicine(TIGEM)客員研究員.15年徳島大学大学院医歯薬学研究部助教(現職).
研究テーマと抱負学生の頃からリソソーム病の病態解析と治療法開発に従事している.最近では,リソソーム生合成に関わるTFEBとオートファジーについて研究を行っている.今後は様々な疾患におけるリソソームストレスに関して研究を行いたい.
ウェブサイトhttp://www.tokushima-u.ac.jp/ph/faculty/labo/btc/
趣味セリエA観戦.
 伊藤 孝司(いとう こうじ)
伊藤 孝司(いとう こうじ)徳島大学大学院医歯薬学研究部教授.徳島大学大学院薬科学教育部附属医薬創製教育研究センター長.博士(薬学).
略歴1957年岐阜県に生れる.81年京都大学薬学部薬学科卒業.83年同大学院薬学研究科修士課程修了.86年東京大学大学院薬学研究科博士課程修了.同年(財)東京都臨床医学総合研究所研究員.95年同研究所主任研究員.99年徳島大学薬学部教授.2003年徳島大学大学院ヘルスバイオサイエンス研究部教授.09年徳島大学大学院薬科学教育部附属医薬創製教育研究センター長.15年徳島大学大学院医歯薬学研究部教授(現職).同年康楽賞.
研究テーマと抱負大学院博士課程では,昆虫生化学,医学研究所では,糖鎖蓄積を伴う遺伝性リソソーム酵素欠損症(リソソーム病)の研究を開始し,これまでリソソーム病の病態解明と治療法開発に取り組んできました.近年は,これらの研究成果を組み合わせ,カイコと糖鎖工学を利用するリソソーム病治療薬を実現させたいと考えています.
ウェブサイトhttp://www.tokushima-u.ac.jp/ph/faculty/labo/btc/
趣味クラッシック音楽鑑賞,チェロ練習(最近,再開).