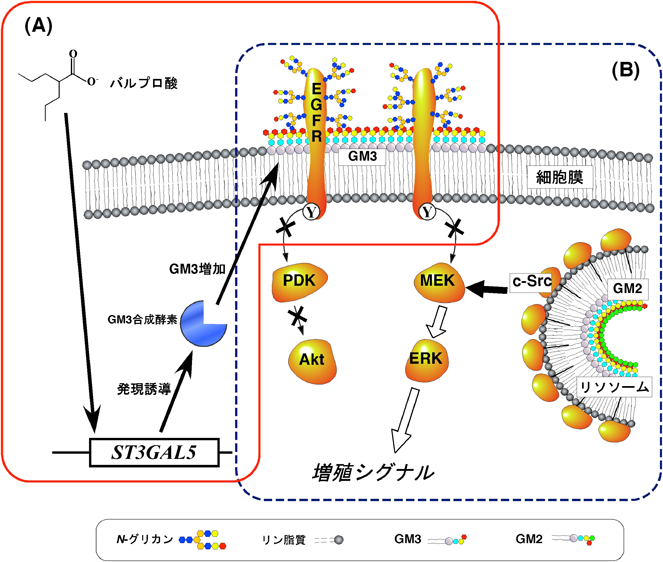
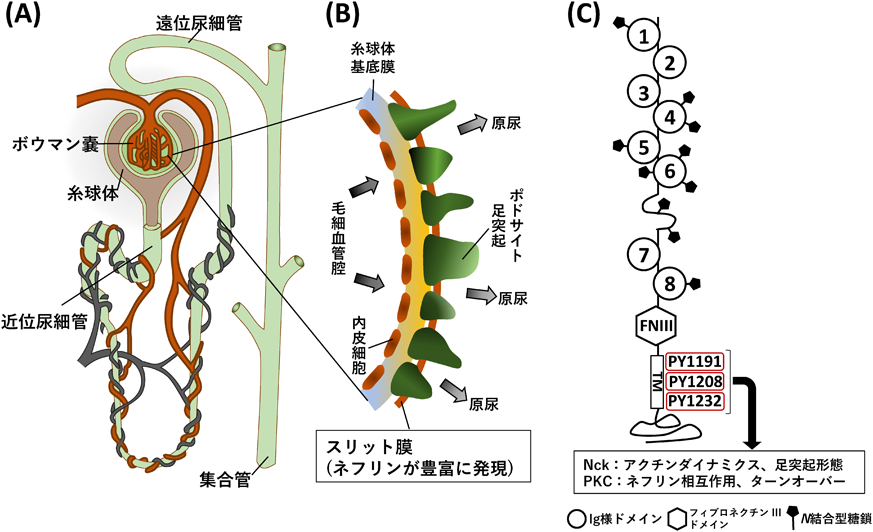
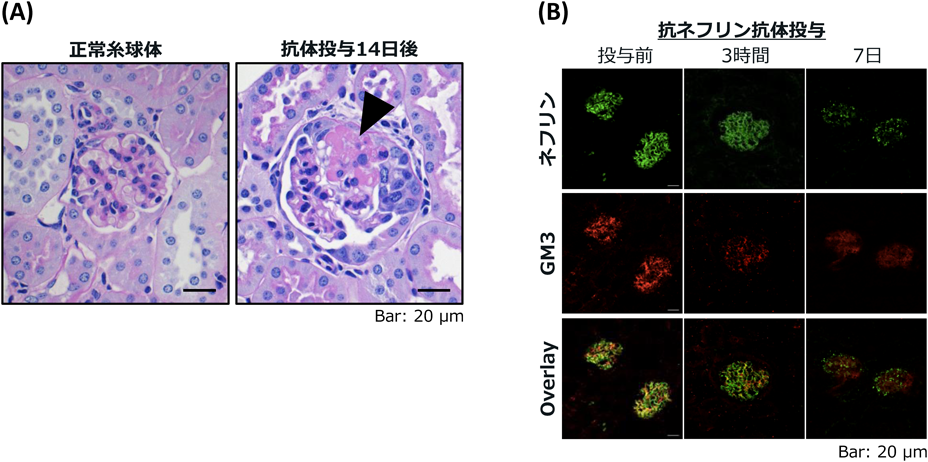
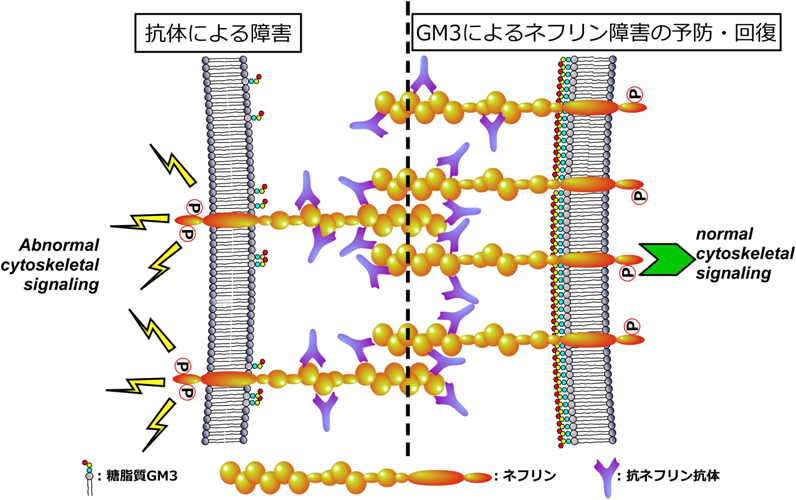
スフィンゴ糖脂質による細胞膜分子制御機構の普遍性Control mechanism of cell membrane molecules by sphingoglycolipids
1 北里大学医学部腎臓内科Department of Nephrology, Kitasato University School of Medicine ◇ 〒252–0374 神奈川県相模原市南区北里1–15–1 ◇ 1–15–1 Kitasato, Minami, Sagamihara, Kanagawa 252–0374, Japan
2 国立研究開発法人産業技術総合研究所機能化学研究部門Research Institute for Sustainable Chemistry, National Institute of Advanced Industrial Science and Technology (AIST) ◇ 〒739–0046 広島県東広島市鏡山3–11–32 ◇ 3–11–32 Kagamiyama, Higashi-hiroshima, Hiroshima 739–0046, Japan