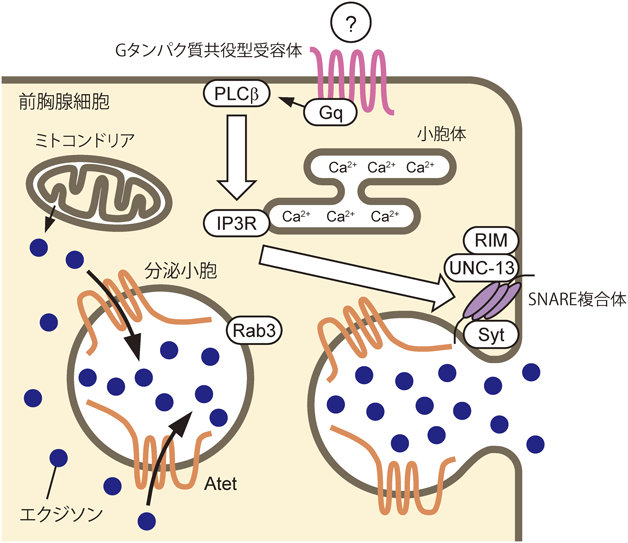
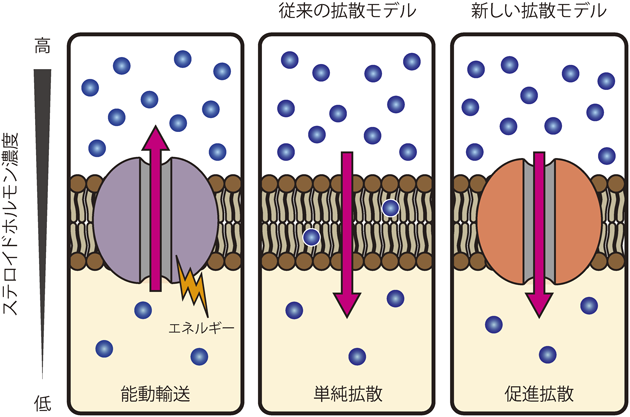
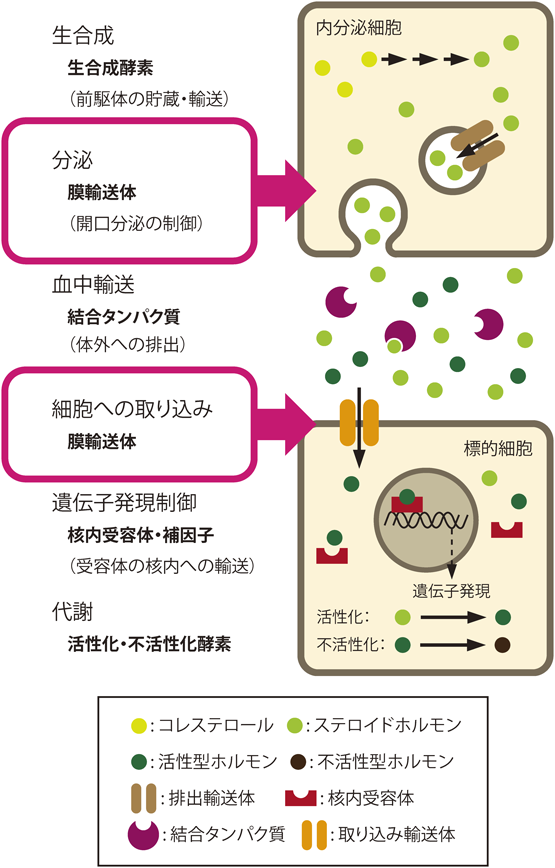
ステロイドホルモン分泌の新たな分子機構とその意義A novel molecular mechanism for steroid hormone secretion and its significance
カリフォルニア大学リバーサイド校University of California, Riverside ◇ 900 University Avenue, Riverside, CA 92521, USA ◇ 900 University Avenue, Riverside, CA 92521, USA