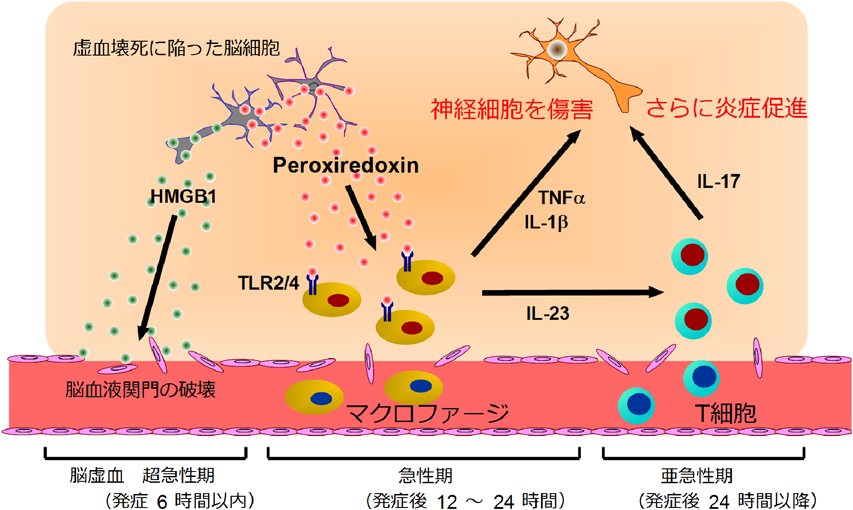
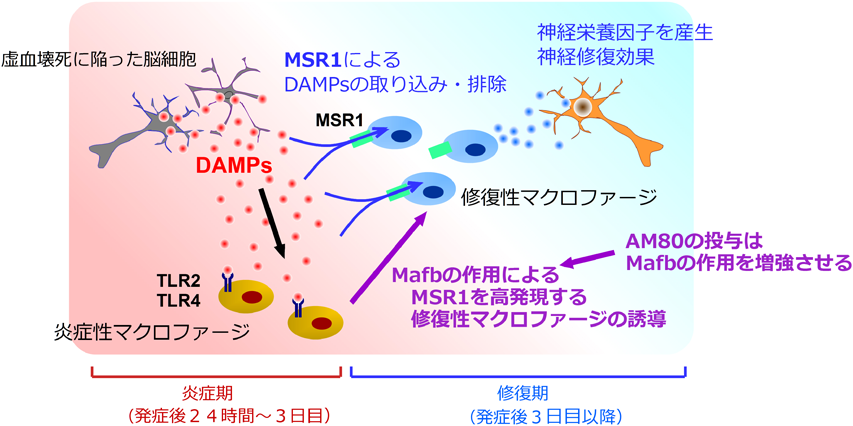
スカベンジャー受容体を介した無菌的炎症の収束メカニズムThe mechanism underlying the resolution of sterile inflammation through scavenger receptor
1 東京都医学総合研究所脳卒中ルネサンスプロジェクトStroke Renaissance Project, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6
2 国立研究開発法人日本医療研究開発機構Japan Agency for Medical Research and Development
3 慶應義塾大学医学部微生物学免疫学教室Department of Microbiology and Immunology, School of Medicine, Keio University