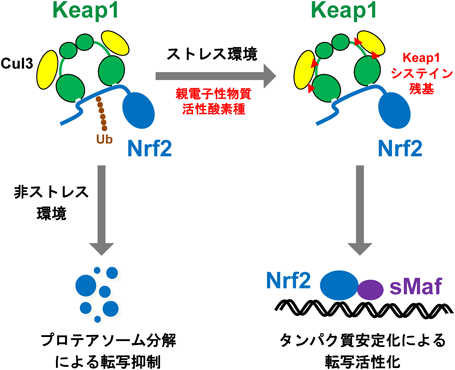
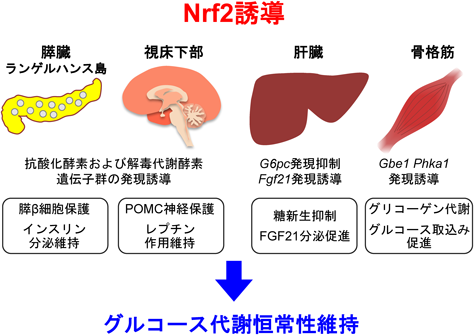
Nrf2によるグルコース代謝恒常性維持機構の解明Keap1-Nrf2 system in the maintenance of glucose metabolisms homeostasis
東北大学東北メディカル・メガバンク機構ゲノム解析部門Department of Integrative Genomics, Tohoku Medical Megabank Organization, Tohoku University ◇ 〒980–8573 宮城県仙台市青葉区星稜町2–1 ◇ 2–1 Seiryo-machi, Aoba-ku, Sendai, Miyagi 980–8573, Japan