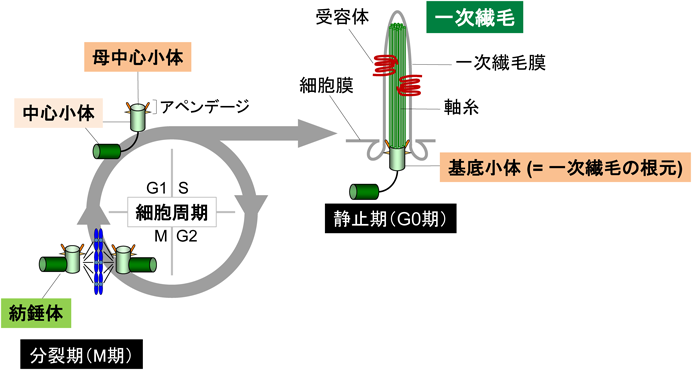
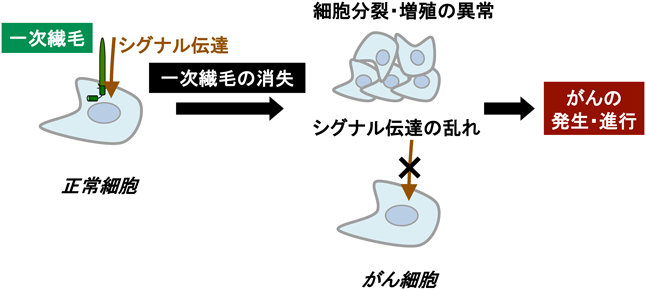
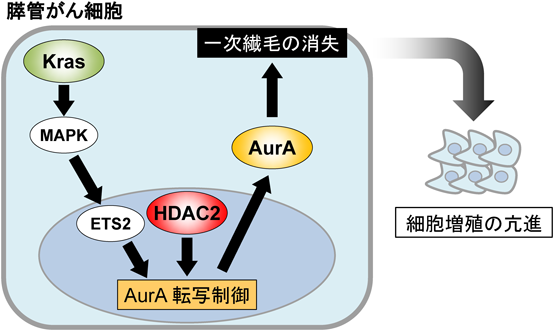
がん細胞における一次繊毛消失メカニズムMolecular mechanism of loss of primary cilia in cancer cells
奈良先端科学技術大学院大学バイオサイエンス研究科Graduate School of Biological Sciences, Nara Institute of Science and Technology ◇ 〒630–0192 奈良県生駒市高山町8916–5 ◇ 8916–5 Takayama-cho, Ikoma, Nara 630–0192, Japan