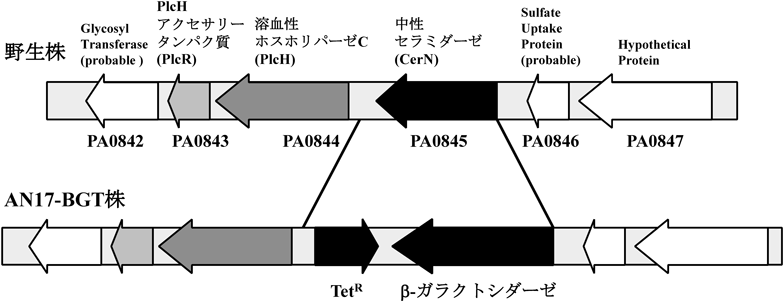
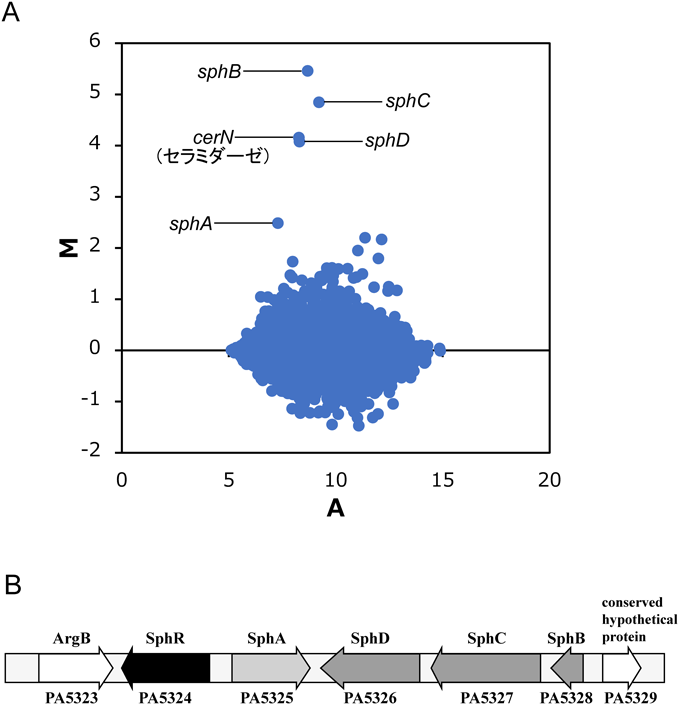
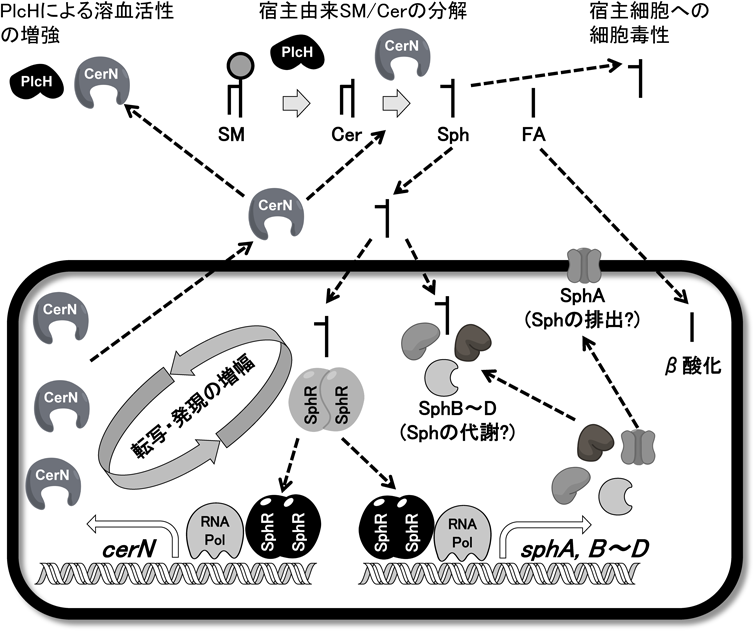
スフィンゴシンに特異的な転写制御因子を介した緑膿菌セラミダーゼの発現誘導機構とその生理的意義Molecular mechanism for Pseudomonas ceramidase expression through sphingosine-specific transcriptional regulator and its biological roles
九州大学大学院農学研究院生命機能科学部門Department of Bioscience and Biotechnology, Graduate School of Bioresource and Bioenvironmental Sciences, Kyushu University ◇ 〒812–8581 福岡市東区箱崎6–10–1 ◇ 6–10–1 Hakozaki, Higashi-ku, Fukuoka 812–8581, Japan