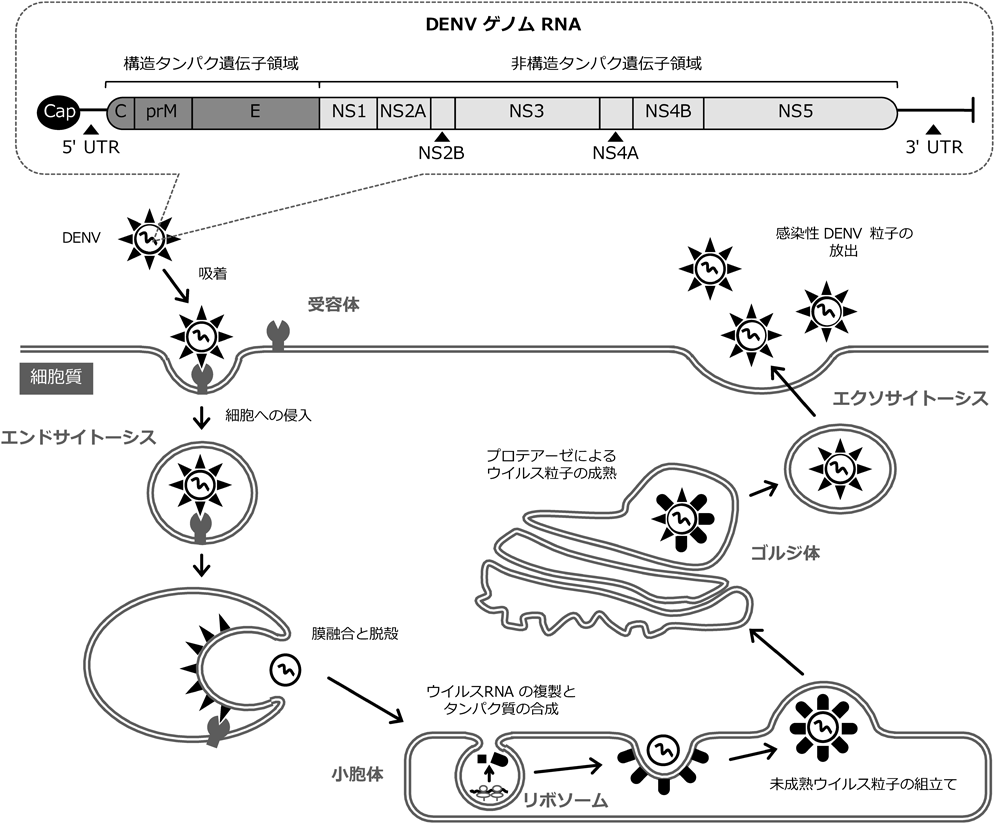
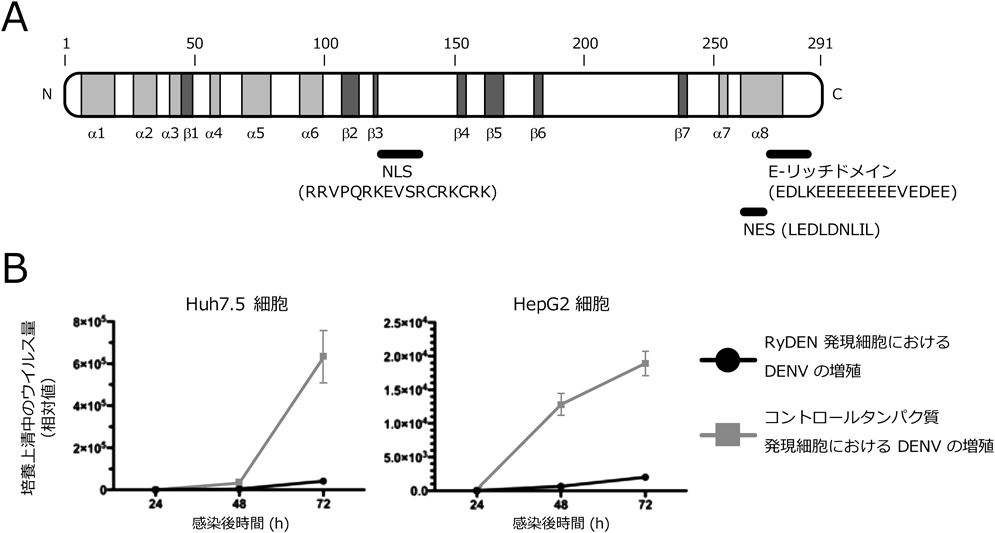
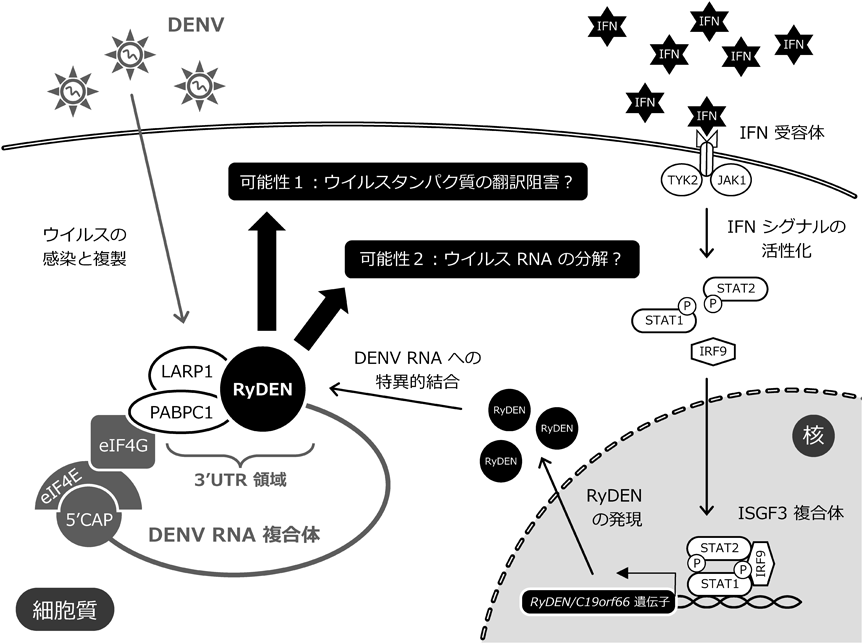
1) Fernandez-Garcia, M., Mazzon, M., Jacobs, M., & Amara, A. (2009) Cell Host Microbe, 5, 318–328.
7) Diamond, M.S., Roberts, T.G., Edgil, D., Lu, B., Ernst, J., & Harris, E. (2000) J. Virol., 74, 4957–4966.
8) Suzuki, Y., Chin, W.X., Han, Q., Ichiyama, K., Lee, C.H., Eyo, Z.W., Ebina, H., Takahashi, H., Takahashi, C., Tan, B.H., Hishiki, T., Ohba, K., Matsuyama, T., Koyanagi, Y., Tan, Y.J., Sawasaki, T., Chu, J.J., Vasudevan, S.G., Sano, K., & Yamamoto, N. (2016) PLoS Pathog., 12, e1005357.
12) Balinsky, C.A., Schmeisser, H., Wells, A.I., Ganesan, S., Jin, T., Singh, K., & Zoon, K.C. (2017) J. Virol., 91, e01606–e01616.
13) Kurane, I., Innis, B.L., Nimmannitya, S., Nisalak, A., Meager, A., & Ennis, F.A. (1993) Am. J. Trop. Med. Hyg., 48, 222–229.
14) Ajariyakhajorn, C., Mammen, M.P. Jr., Endy, T.P., Gettayacamin, M., Nisalak, A., Nimmannitya, S., & Libraty, D.H. (2005) Antimicrob. Agents Chemother., 49, 4508–4514.