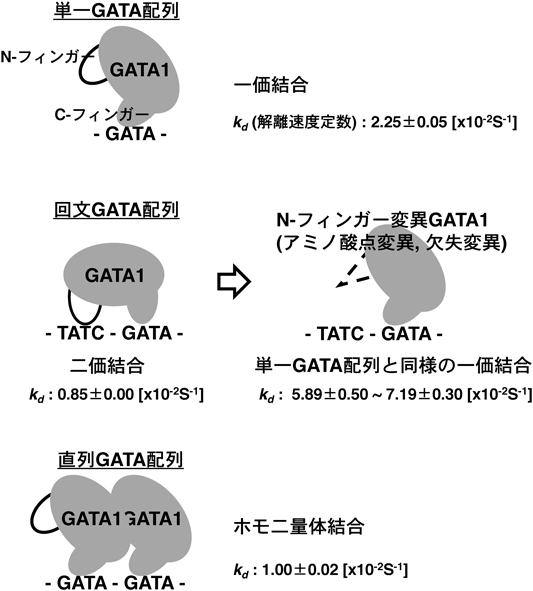
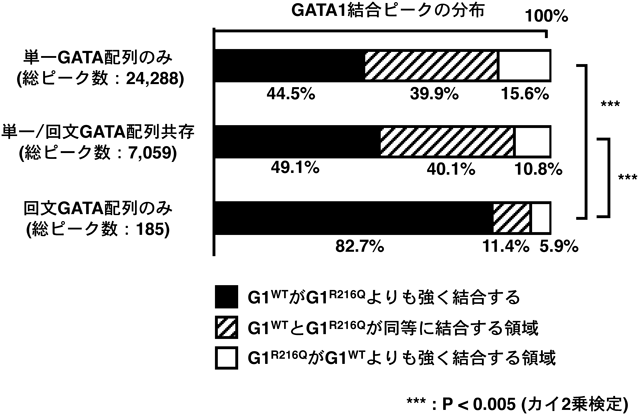
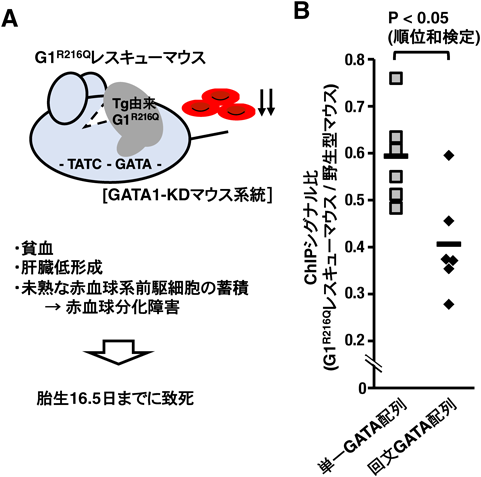
複数のDNA結合ドメインを介したシス配列依存的GATA1機能修飾Multiple DNA-binding domains modify GATA1-DNA interaction on the specific configuration of cis-acting elements
東北大学大学院医学系研究科分子血液学分野Department of Molecular Hematology, Tohoku university school of medicine ◇ 宮城県仙台市青葉区星陵町2–1 ◇ 2–1 Seiryo-machi, Aoba-ku, Sendai 980–8575, Japan